Количество вещества. Моль
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль – это количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов, электронов или других частиц), сколько атомов содержится в 12 г (0,012 кг) изотопа углерода 12С.
Зная массу одного атома 12С, можно подсчитать число атомов NA в 0,012 кг углерода 12С: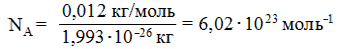
Поэтому используется также следующее определение:
Моль – это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов, электронов или других), равное постоянной Авогадро, то есть 6,02·1023 моль-1.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню).
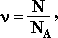
-
где N – число структурных единиц данного вещества;
NA – число структурных единиц, которое содержит 1 моль вещества (постоянная Авогадро).
Заметим, что вычисление ν используется практически в каждой расчётной задаче.








