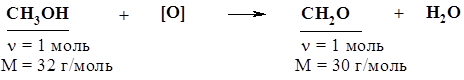
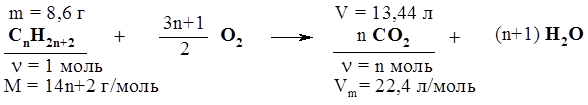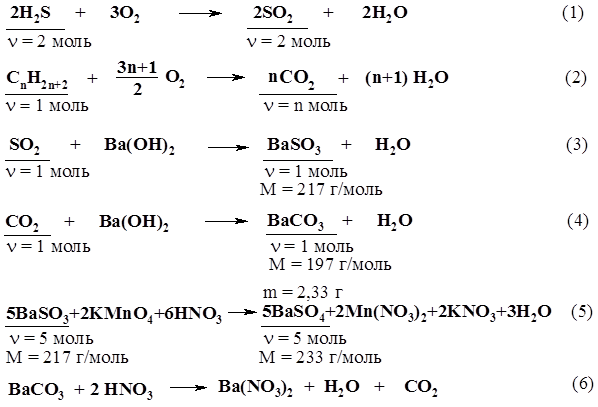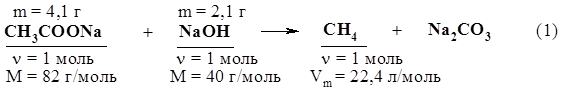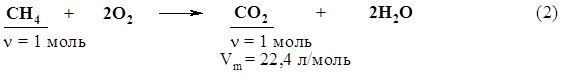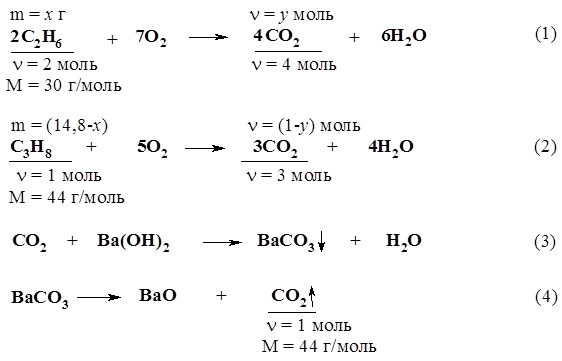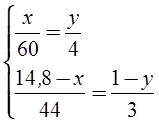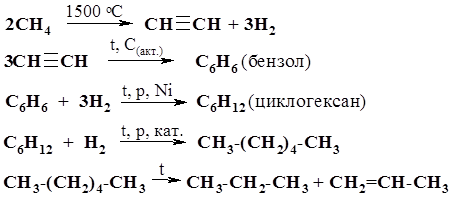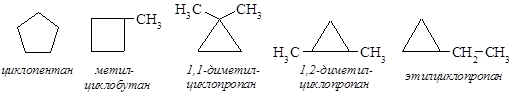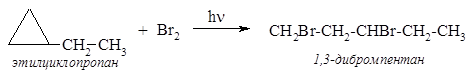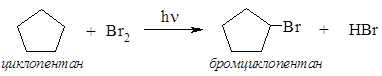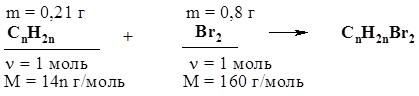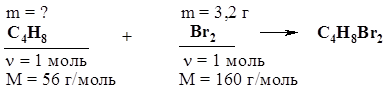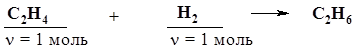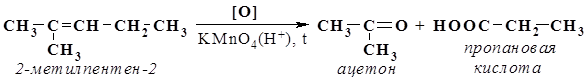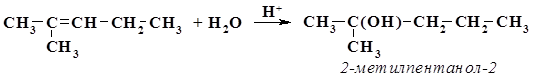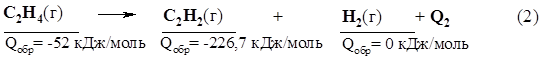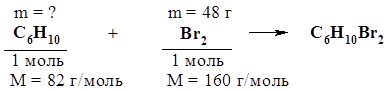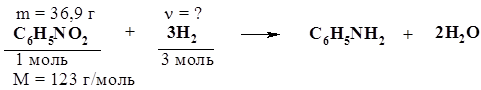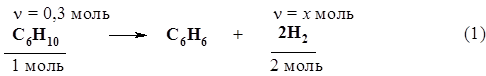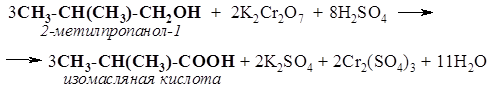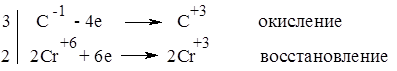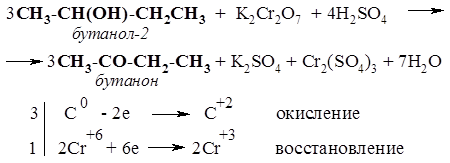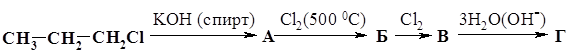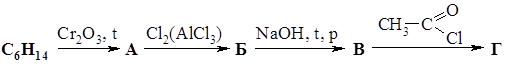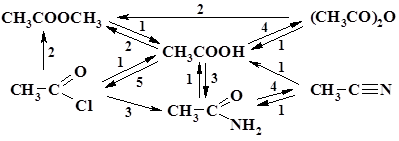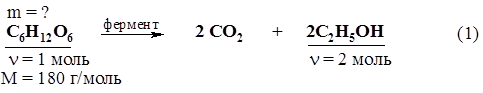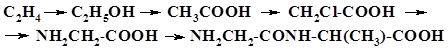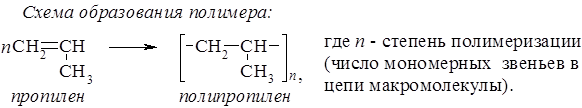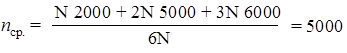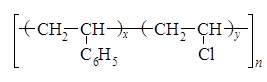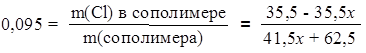|
СБОРНИК ЗАДАЧ И УПРАЖНЕНИЙ
В данном cборнике представлены расчётные и качественные задачи, содержание которых основано на анализе контрольно-измерительных материалов ЕГЭ по химии, программ вступительных экзаменов в некоторые ведущие российские вузы и задач химических олимпиад. Это главным образом комплексные задания, требующие хорошего знания теории, логического мышления и умения производить химические расчеты. Решение задач – отличный способ закрепить знания, поэтому после изучения теории по определенной теме рекомендуется незамедлительно приступить к работе над задачами, которые здесь сгруппированы по классам органических соединений (к некоторым задачам даны решения).
Примечание: более сложные задачи отмечены знаком *.
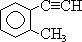
1.4. Ароматические углеводороды 2. Кислородсодержащие соединения 2.3. Карбоновые кислоты и их производные 4. Высокомолекулярные соединения 1. Углеводороды
1. При сгорании некоторого вещества массой 4,6 г образовался оксид углерода (IV) объемом 7,84 л (при н.у.) и пары воды массой 3,6 г. Определите формулу вещества, если относительная плотность его паров по водороду равна 46. Решение Определение химической формулы вещества сводится к вычислению соотношения количества молей составляющих его элементов. n(С) = n(СО2) = V(CO2) / Vm = 7,84 л / 22,4 л/моль = 0,35моль; n(Н) = 2n(Н2О) = 2m(Н2О) / М(Н2О) = 2 × 3,6 г / 18 г/моль = 0,4 моль; m(С) = n(С) × М(С) = 0,35 моль × 12 г/моль = 4,2 г; m(Н) = n(Н) × М(Н) = 0,4 моль × 1 г/моль = 0,4 г; m(С) + m(Н) = 4,2 г + 0,4 г = 4,6 г, что соответствует m(вещества). Следовательно, это вещество содержит только углерод и водород, т.е. является углеводородом. n(С) : n(Н) = 0,35 : 0,4 = 35 : 40 = 7 : 8. Простейшая формула С7Н8. М(углеводорода) =DH2 × M(H2) = 46 × 2 г/моль= 92 г/моль; М(С7Н8) = 92 г/моль. Таким образом, простейшая и молекулярная формулы вещества в данном случае совпадают. Ответ: С7Н8. 2. Плотность по водороду паров углеводорода равна 42. Выведите молекулярную формулу этого соединения, зная, что при сгорании 12,6 г его образуется 39,6 г СО2 и 16,2 г воды. 3. При сгорании газа массой 8,4 г образовался оксид углерода (IV) массой 26,4 г и вода массой 10,8 г. Установите молекулярную формулу соединения, если его плотность при н.у. равна 1,875 г/л.
1.1. Алканы. Циклоалканы
4. Какова молекулярная формула газообразного предельного углеводорода с открытой углеродной цепью, если масса 11,2 л его при н.у. составляет 22 г? Решение Предельный углеводород ациклического строения – алкан. Общая формула алканов СnH2n+2. 1. Определяем количество вещества алкана: n(СnH2n+2) = V(СnН2n+2) / Vm(CnН2n+2) = 11,2 л / 22,4 л/моль = 0,5 моль. 2. Определяем молярную массу вещества: М(СnН2n+2) = m(СnН2n+2) / n(СnН2n+2) = 22 г / 0,5 моль = 44 г/моль. Кроме того, М(СnН2n+2) = 12n + 2n + 2 = 14n + 2. 3. Определяем n: 14n + 2 = 44, отсюда n = 3. Ответ: молекулярная формула алкана С3Н8. 5. Установите молекулярную формулу предельного ациклического углеводорода, если плотность его паров по водороду равна 36. Сколько изомеров соответствует этой формуле? 6. Определите молекулярную формулу алкана, если известно, что при полном сгорании 8,6 г этого соединения образовалось 13,44 л углекислого газа (н.у.). Решение 1. Составим уравнение реакции сгорания алкана в общем виде:
2. Находим количества веществ углеводорода и СО2: n(CnH2n+2) = (СnН2n+2) / М(СnН2n+2) = 8,6 г / 14n +2 г/моль; n(СО2) = V(СО2) / Vm = 13,44 л / 22,4 л/моль = 0,6 моль. 3. Согласно уравнению реакции, n(СО2) в n раз больше n(СnН2n+2), поэтому составим уравнение и решим его относительно n: 8,6 n / 14n+2 = 0,6; n = 6, то есть формула углеводорода С6Н14. Ответ: С6Н14. 7. На полное сгорание алкана количеством вещества 0,5 моль израсходован воздух объемом 280 л (н.у.). Какова молекулярная формула вещества, если объемная доля кислорода в воздухе составляет 20%? 8. Смесь 2 л газообразного алкана и 5 л кислорода подожгли в замкнутом сосуде. По окончании реакции продукты привели к первоначальным условиям, после чего объем смеси стал равен 4 л, а после пропускания ее через избыток раствора щелочи уменьшился до 1 л, причем оставшийся газ не поддерживает горения. Определите молекулярную формулу углеводорода. 9.* Смесь сероводорода и неизвестного алкана, взятых в объемном соотношении 1 : 3, сожжена и продукты сгорания полностью поглощены избытком водного раствора гидроксида бария. В результате выпало 19,9 г осадка, масса которого при обработке избытком раствора КМnО4, подкисленного НNО3, уменьшилась до 2,33 г. Установите молекулярную формулу алкана. Решение Составим уравнения всех реакций, о которых говорится в условиях задачи.
Из уравнения (5) n(BaSO3) = n(BaSO4) = 2,33 г / 233 г/моль = 0,01 моль. m(BaSO3) = n(BaSO3) × M(BaSO3) = 0,01 моль × 217 г/моль = 2,17 г. m(BaСO3) = 19,9 г – 2,17 г = 17,73 г. n(СnH2n+2) = n(СO2) = n(BaСO3) = 17,73 г / 197 г/моль = 0,09 моль. n(Н2S) = n(SO2) = n(BaSO3) = 0,01моль. Тогда по условию задачи n(СnH2n+2) = 0,03 моль. Исходя из уравнения (2), получаем n = 0,09 : 0,03 = 3. Ответ: С3Н8. 10. Какой объем углекислого газа выделится и какой объем воздуха истратится (н.у.) при сжигании всего метана, полученного взаимодействием 4,1 г ацетата натрия с 2,1 г едкого натра. Учесть, что объемная доля кислорода в воздухе равна 21%. Решение 1. Запишем краткие условия задачи, используя уравнения реакций с указанием количественных характеристик тех веществ, которые необходимы для расчета.
2. Определим количества вещества обоих реагентов. n(СН3СООNа) = m(СН3СООNа) / М(СН3СООNа) = = 4,1 г / 82 г/моль = 0,05 моль; n(NаОН) = m(NаОН) / М(NаОН) = 2,1 г / 40 г/моль = 0,0525 моль. 3. Едкий натр взят в избытке, поэтому расчет продуктов реакции проведем по ацетату натрия. n(СО2) = n(СН4) = n(СН3СООNа) = 0,05 моль; V(СО2) = n(СО2) × Vm = 0,05 моль × 22,4 л/моль = 1,12 л; n(О2) = 0,05 моль×2 = 0,1 моль, V(О2) = 0,1 моль × 22,4 л/моль = 2,24 л; V(воздуха) = 2,24 л × 100 / 21 = 10,7 л. Ответ: V(воздуха) = 10,7 л. 11. Какого состава соль образуется в результате пропускания углекислого газа, полученного при сжигании всего этана, выделяющегося при прокаливании пропионата натрия, массой 9,6 г с едким натром массой 4,1 г через 80 г 10%-ного раствора едкого натра. Определите массу этой соли. 12. Какой объем хлора, измеренный при нормальных условиях, потребуется для хлорирования метана, полученного гидролизом карбида алюминия массой 30 г, содержащего 4% по массе примесей? Продуктом хлорирования метана является хлороформ. 13. При взаимодействии 6,45 г хлорэтана и 2,5 г металлического натрия было получено 2,5 г бутана. Определите массовую долю выхода продукта реакции. 14.* Смесь этана и пропана массой 14,8 г сожгли, полученный газообразный продукт пропустили в избыток гидроксида бария в растворе и получили осадок. В результате прокаливания высушенного осадка его масса уменьшилась на 44 г. Определите массовые доли этана и пропана в смеси. Решение Запишем уравнения реакций с учетом условий задачи:
В соответствии с уравнением (4), уменьшение массы осадка после прокаливания произошло в результате выделения 44 г углекислого газа. Следовательно, n(СО2) = 1 моль. На основании уравнений (1) и (2) составляем систему уравнений с двумя неизвестными, приняв массу этана за х г, а количество вещества углекислого газа, выделившегося в результате реакции (1), за у моль.
В результате алгебраических преобразований получим х = 8 г. w(С2Н6) = 8 г / 14,8 г = 0,54 (54%); w(С3Н8) = 1 – 0,54 = 0,46 (46%). Ответ: w(С2Н6) = 54%; w(С3Н8) = 46%. 15.* Для поглощения СО2, выделяющегося при сгорании смеси СН4 и С3Н8, необходимо затратить минимум 1,5 л 2М раствора КОН. Определите объем (при н.у.) исходной смеси, если ее относительная плотность по водороду равна 11,5. 16. При термическом разложении метана объемом 313,6 л (н.у.) был получен ацетилен, объем которого при н.у. составил 120,96 л. Вычислите массовую долю выхода продукта в %. 17. Какой объем 10%-ного раствора едкого натра (r = 1,1 г/мл) потребуется для поглощения всего хлороводорода, выделившегося при радикальном хлорировании 3,36 л метана (н.у.), если получается продукт полного замещения водорода? 18.* При хлорировании 96 г алкана образовалась смесь моно-, ди- и трихлорзамещенных углеводородов с тем же числом углеродных атомов, что и в исходной молекуле. Объемные соотношения продуктов реакции в газовой фазе (н.у.) 1 : 2 : 3, а плотность паров по водороду дихлорзамещенного углеводорода 42,5. Найдите состав образовавшейся смеси. 19. При сжигании смеси этана и циклопропана массой 8,8 г образовался оксид углерода (IV) объемом 13,44 л (н.у.). Определите массовые доли углеводородов в смеси. 20. Смесь азота с метаном объемом 2 л после поджигания взаимодействует с кислородом объемом 2 л (объемы газов измерены при одинаковых условиях). Определите объемные доли газов в исходной смеси. 21. Для сжигания 20 л смеси метана и пропана израсходовано 55 л кислорода. Вычислите состав газовой смеси в объемных процентах. 22. Смесь пропана, метана и оксида углерода (IV) занимает объем 6,165 л. После сжигания смеси в избытке кислорода получено 11,565 л СО2. Определите содержание пропана в смеси в процентах по объему. Объемы газов измерены при нормальных условиях. 23. Продукты полного сгорания (в избытке кислорода) 6,72 л (н.у.) смеси этана и пропана обработали избытком известковой воды, причем образовалось 80 г осадка. Каков количественный состав исходной смеси? 24. Известно термохимическое уравнение реакции горения метана: СН4 + 2О2 ¾® СО2 + 2Н2О + 890 кДж. Какое количество вещества метана расходуется при выделении 89 кДж теплоты? 25.* При полном сгорании 10,2 л смеси пропана и бутана в стандартных условиях выделилось 1308 кДж теплоты. Вычислите состав смеси в объемных процентах (стандартные молярные теплоты образования пропана, бутана, СО2 и Н2О в кДж/моль, соответственно равны: 103,8; 124,7; 393,5; 285,8). 26. Определите формулу циклоалкана, на сгорание которого затрачивается объем кислорода в 9 раз больший, чем объем паров циклоалкана. Назовите этот циклоалкан, если известно, что его углеродный скелет имеет неразветвленное строение. 27. При сжигании одного объема некоторого циклоалкана требуется в 4,5 раза больший объем кислорода. Какого состава соль образуется, если весь СО2, полученный при сжигании 4,48 л (н.у.) этого углеводорода пропустить через 6 л 0,1М раствора NаОН? Определите массу этой соли. 28. Из пропанола, серной кислоты, бромида калия и металлического натрия получите два изомерных алкана. Укажите условия протекающих реакций. 29. Напишите уравнения реакций, с помощью которых, исходя из метана, можно получить углеводороды других классов: алкен, алкин, арен, циклоалкан. Никаких других реагентов, кроме продуктов превращения одного углеводорода в другой, использовать нельзя (катализаторы – любые).
Решение
30*. Два углеводорода состава С5Н10, не имеющие стереоизомеров, взаимодействуют с бромом на свету. Один (А) образует 1,3-дибромпроизводное неразветвленного строения, другой (В) – единственное монобромпроизводное. Определите строение исходных углеводородов и объясните причины различного направления реакций. Решение Формулу С5Н10 могут иметь алкены и циклоалканы. Поскольку алкены в реакции с бромом не образуют ни моно-, ни 1,3-дибромпроизводных, то данные изомерные углеводороды относятся к ряду циклоалканов. Формуле С5Н10 соответствуют 5 структурных изомеров этого ряда:
Циклопропан и его производные вступают в реакцию присоединения брома с раскрытием напряженного 3-членного цикла. Соединением А может быть только этилциклопропан:
Остальные 3-членные циклы не отвечают условиям задачи: а) 1,1-диметилциклопропан может образовать только разветвленный дибромалкан; б) 1,2-диметилциклопропану соответствуют 3 стереоизомера (часть II, раздел 3.1). Более устойчивые 4-х и 5-членные циклы реагируют с бромом без раскрытия цикла, вступая в реакцию замещения. Метилциклобутан может образовать смесь изомеров (с преобладанием 1-бром-1-метилциклобутана – продукта замещения у третичного атома углерода, см. часть I, раздел 6.5.3). Следовательно, соединением В является циклопентан, образующий только один продукт замещения:
31. Напишите уравнения реакций всех стадий в цепи превращений:
32. Объясните строение веществ, преимущественно образующихся на каждой стадии в приведенной цепи превращений. Назовите все соединения.
33. Напишите уравнения реакций в следующей цепи превращений:
Укажите тип реакций 1 и 3. 34. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
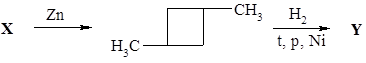
35. Напишите формулы соединений X и Y в схеме превращений:
1.2. Алкены. Алкадиены
36. Определите молярную массу углеводорода с открытой цепью углеродных атомов, если при сжигании его количеством 0,4 моль образовались пары воды массой 21,6 г и оксид углерода (IV) объемом 35,84 л (н.у.). 37. Определите молекулярную формулу углеводорода ряда этилена, если 0,21 г его присоединяет бром массой 0,8 г. Решение Составим уравнение реакции в общем виде:
Согласно уравнению реакции, n(СnH2n) = n(Br2). Отсюда: 0,21 г / 14n г/моль = 0,8 г / 160 г/моль. Решая уравнение, получаем n = 3. Ответ: С3Н6. 38. При взаимодействии 11,2 г алкена с бромоводородом получено 27,4 г вещества. Напишите формулы изомерных алкенов и дайте им названия. 39. При дегидратации над оксидом алюминия спирта массой 125 г был получен алкен объемом 42 л (н.у.). Объемная доля выхода продукта составила 69%. Какова молекулярная формула алкена? 40. На полное гидрирование этиленового углеводорода массой 14 г затрачен водород объемом 4,48 л (н.у.). Какова молекулярная формула этого углеводорода? 41. Установите молекулярную формулу этиленового углеводорода, зная, что после его взаимодействия с избытком бромоводорода молярная масса продукта оказалась в 2,45 раз больше, чем у исходного углеводорода. 42. Смесь массой 5,28 г, содержащая бутан и бутен-2, обесцветила 32 г 10%-ного раствора брома в тетрахлориде углерода. Найдите массовую долю бутана в смеси. Решение Найдем массу брома в растворе: m(Br2) = m(раствора) × w(Br2) =32 г × 0,1 = 3,2 г. С бромом будет реагировать в данных условиях только бутен-2 по схеме:
n(Br2) = m(Br2) / M(Br2) = 3,2 г / 160 г/моль = 0,02 моль; n(С4Н8) = n(Br2) = 0,02 моль; m(С4Н8) = n(С4Н8) × М(С4Н8) = 0,02 моль × 56 г/моль = 1,12 г; w(С4Н8) = m(C4H8) / m(смеси) = 1,12 г / 5,28 г = 0,212 (21,2%). m(C4Н10) = 5,28 г – 1,12 г = 4,16 г; w(С4Н10) = m(C4H10) / m(смеси) = 4,16 г / 5,28 г = 0,788 (78,8%). Ответ: w(С4Н8) = 21,2%. 43. Смесь этана и этилена объемом 4 л (н.у.) пропустили через раствор брома в воде, при этом получилось 3,76 г продукта реакции. Определите массовую долю этилена в смеси. 44. 3 л смеси (н.у.) этана и этилена пропущены через раствор брома. При этом образовалось 4,7 г 1,2-дибромэтана. Определите объемные доли газов в смеси. 45.* Эквимолекулярная смесь двух газообразных углеводородов (алкана и алкена), содержащих одинаковое число атомов углерода в молекуле, может обесцветить 80 г раствора брома в четыреххлористом углероде с массовой долей брома 20%. При сожжении того же количества смеси углеводородов образуется 13,44 л (н.у.) диоксида углерода. Какие углеводороды и в каком количестве содержатся в смеси? 46. Смесь этана, этилена и водорода объемом 27 л пропустили над нагретым платиновым катализатором. По окончании реакции смесь привели к начальным условиям. Объем ее уменьшился до 20 л, из которых 1 л приходится на непрореагировавший водород. Определите объемные доли газов в исходной смеси. Решение В указанных условиях в реакцию вступают этилен и водород, причем водород взят в избытке, следовательно, этилен прореагирует полностью.
Реакционная смесь уменьшилась в объеме на 7 л за счет прореагировавшего водорода, следовательно, первоначальный объем водорода составлял 7 л + 1 л = 8 л. Объем этилена в соответствии со стехиометрическими соотношениями и законом Авогадро равен 7 л. Соответственно, V(С2Н6) = 27 л – 7 л – 8 л = 12 л. j(С2Н6) = V(C2H6) / V(смеси) = 12 л / 27 л = 0,444 (44,4%). j(С2Н4) = 7 л / 27 л = 0,259 (25,9%). j(Н2) = 8 л / 27 л = 0,296 (29,6%). Ответ: j(С2Н6) = 44,4 %; j(С2Н4) = 25,0%; j(Н2) = 29,6%. 47. К 1 л смеси этана и этилена добавили 1 л водорода и полученную смесь пропустили над никелевым катализатором. Объем смеси после пропускания, приведенной к тем же условиям, составил 1,3 л. Установите состав исходной смеси в % (по объему). 48. Газ, образовавшийся при нагревании 28,75 мл предельного одноатомного спирта (r = 0,8 г/мл) с концентрированной серной кислотой, присоединяет 8,96 л (н.у.) водорода. Определите, какой спирт был использован в реакции, если выход углеводорода составляет 80% от теоретического. 49. При нагревании органического бромопроизводного, содержащего 35% углерода и 6,6% водорода, со спиртовым раствором щелочи образуется соединение, 210 мг которого при сжигании дают 660 мг СО2 и 270 мг воды. Плотность паров этого соединения по гелию равна 14. Каковы молекулярные формулы исходного вещества и продукта реакции? 50. При гидрировании смеси бутана и бутена-2 плотность ее (смеси) по водороду возросла на 0,5. Вычислите состав исходной смеси в объемных процентах. 51. Cмесь пропана и пропена объемом 1,6 л (н.у.), содержащая 56% пропена по объему, смешана в темном сосуде при температуре 0 °С с газом, полученным при действии 3,5 г перманганата калия на 26,5 мл раствора хлороводородной кислоты с массовой долей HCl 20% (r = 1,1 г/мл). Найдите состав смеси газов в массовых долях после того, как реакционный сосуд будет охлажден до 0 °С (дихлорпропан – жидкость). 52. Выведите молекулярную формулу и определите молярную массу изопрена, если при сжигании его массой 2 г образовалась вода массой 2,12 г и оксид углерода (IV) массой 6,48 г. 53. Из пропанола, серной кислоты, бромида калия и металлического натрия получите два изомерных алкана. Укажите условия протекающих реакций. 54. При дегидратации предельного одноатомного спирта образуется алкен, окисление которого перманганатом калия в кислой среде дает изомасляную кислоту и ацетон. Приведите все возможные структурные формулы исходного спирта, напишите уравнения всех протекающих реакций. 55. Углеводород состава С6Н12 обесцвечивает раствор брома, при гидратации образует третичный спирт, а при окислении концентрированным раствором перманганата калия превращается в ацетон и пропановую кислоту. Определите строение углеводорода, напишите его название и приведите уравнения происходящих реакций. Решение Данный углеводород принадлежит к гомологическому ряду алкенов, так как его состав соответствует общей формуле СnH2n, и он обесцвечивает бромную воду. 1. По продуктам деструктивного окисления алкена перманганатом калия можно установить положение двойной связи в его молекуле. Алкен С6Н12 при окислении превращается в ацетон и пропановую кислоту. Следовательно, его строение отражает формула (CH3)2C=CH-CH2-CH3 (2-метилпентен-2).
2. Обесцвечивание раствора брома:
3. Гидратация с образованием третичного спирта (по правилу Марковникова):
56*. Углеводород состава С7Н14 (соединение А) при кипячении с KMnO4 в кислой среде образует ацетон и изомасляную (метилпропановую) кислоту. При гидрировании соединение А превращается в продукт Б состава С7Н16. Вещество Б в результате каталитического дегидрирования (Pt, t) образует изомерное веществу А соединение В, которое не обесцвечивает бромную воду. Определите строение соединений А, Б и В. Сколько стереоизомеров соответствует структурной формуле соединения В? 57. Составьте уравнения реакций для цепи превращений:
Объясните механизм реакции 2. 58. Напишите уравнения реакций и структурные формулы продуктов каждой стадии в приведенной схеме превращений. К каким типам относятся эти реакции?
59. Напишите формулы соединений A, Б, В, Г и укажите типы реакций их образования в следующей цепи превращений:
60. Расшифруйте приведенную цепочку превращений:
1.3. Алкины
61. Установите молекулярную формулу углеводорода, при сжигании 0,2 моль которого образовалось 10,8 г воды и 17,92 л углекислого газа (н.у.). Напишите возможные структуры. 62. Определите структурную формулу углеводорода, массовая доля углерода в котором составляет 88,9%. Известно, что углеводород взаимодействует с аммиачным раствором оксида серебра. Плотность паров углеводорода по воздуху составляет 1,862. 63. Карбид кальция поставляется потребителям в барабанах, вмещающих до 130 кг. Какой объем ацетилена (при н.у.) можно получить из такой массы карбида, содержащего 20% примесей? 64. Массовая доля выхода бензола при тримеризации ацетилена составляет 42%. Какую массу ацетилена нужно взять для получения бензола количеством 1 моль? 65. Каков объем ацетилена при н.у., полученного из карбида кальция, если при получении последнего из кокса и негашеной извести образовался оксид углерода (IV) объемом 112 л (н.у.)? 66. При пропускании смеси этана и ацетилена через склянку с бромной водой масса склянки увеличилась на 2,6 г. При полном сгорании такой же массы смеси выделился оксид углерода (IV) объемом 28 л (н.у.). Вычислите объем взятой смеси. 67.* Имеется смесь пропена с ацетиленом с относительной плотностью по водороду, равной 19 (смесь 1). К данной смеси добавили 22,4 л (н.у.) водорода (смесь 2). После пропускания смеси 2 над платиновым катализатором образовалась смесь 3 с плотностью по водороду, равной 12. Определите объем пропена и ацетилена в смеси 1. 68.* На смесь, состоящую из карбида кальция и сульфита бария, подействовали избытком НBr, в результате чего была получена смесь газов с относительной плотностью по диметиламину, равной 1, и раствор, при выпаривании которого образуется твердый остаток массой 248,5 г. Определите массу исходной смеси и массовые доли веществ в ней. 69.* Имеется эквимолекулярная смесь двух изомерных углеводородов А и Б, относящихся к одному классу непредельных соединений, но отличающихся положением кратных связей. При сожжении этой смеси образуется 89,6 л СО2 (н.у.), а при полном каталитическом гидрировании той же смеси может поглотиться 44,8 л Н2 (н.у.). Какие углеводороды и в каком количестве находятся в исходной смеси, если известно, что при взаимодействии этой смеси с аммиачным раствором оксида серебра образуется осадок. 70. Какой объем кислорода потребуется для полного сгорания 1 м3 следующих газов: а) метан; б) этилен; в) ацетилен. Вычислите в каждом отдельном случае объемы выделившегося углекислого газа. Объемы газов измерены при н.у. 71.* Определите тепловой эффект реакции получения 1 моль ацетилена из этана, если известны теплота реакции образования 1 моль этилена из этана (Qреакции = -136,7 кДж) и стандартные молярные теплоты образования веществ: Qобр(С2Н4 (г)) = -52 кДж/моль; Qобр(С2Н2 (г)) = -226,7 кДж/моль. Решение 1. Запишем термохимические уравнения реакций в соответствии с условиями задачи:
Реакцию (3) – превращение этана в ацетилен – можно рассматривать как двухстадийный процесс, состоящий из реакций (1) и (2). 2. Определим тепловой эффект реакции (2), учитывая, что Qобр(Н2 (г)) = 0 (т.к. Н2(г) - простое вещество в устойчивой форме): Q2 = Qобр(С2Н2) - Qобр(С2Н4) = -226,7 + 52 = -174,7 кДж. 3. Согласно закону Гесса (раздел 1.8), тепловой эффект реакции не зависит от числа стадий. Поэтому теплоту образования ацетилена из этана подсчитываем как сумму теплот реакций (1) и (2): Q3 = Qреакции(1) + Q2 = -136,7 -174,7 = -311,4 кДж. Ответ: -311,4 кДж. 72. Какие реакции позволяют осуществить следующие превращения: карбид кальция ® А ® В ® хлорэтан? 73. Напишите уравнения реакций, идущих в цепи превращений:
74. Напишите уравнения реакций для цепи превращений:
1.4. Ароматические углеводороды
75. Определите максимальную массу бензола, которую можно получить из ацетилена, выделившегося из карбида кальция массой 12,8 г с массовой долей примесей 6,8%. 76. Какую массу бензола можно получить из ацетилена, выделяющегося при обработке водой карбида кальция массой 42,7 г с массовой долей примесей 18,4%. Массовая доля выхода бензола составляет 30%. 77. Из ацетилена объемом 3,36 л (н.у.) получили бензол объемом 2,5 мл. Определите массовую долю выхода продукта, если плотность бензола равна 0,88 г/мл. 78. Вычислите массу перманганата калия, необходимую для получения газа, превращающего бензол массой 39 г в гексахлоран. 79. При нагревании до 300 °С гексахлоран превращается в 1,3,5-трихлорбензол. Вычислите объем газа (н.у.), выделившегося из гексахлорана количеством вещества 2 моль. 80. Какой объем (н.у.) природного газа с массовой долей метана, равной 90%, затрачен для получения нитробензола количеством 3 моль? 81.* Установите структурную формулу органического вещества А, не имеющего боковых цепей и обладающего ароматическими свойствами, если известно, что при сгорании 0,384 г этого вещества образуется 1,32 г СО2 и 0,216 г воды. Плотность вещества А по воздуху равна 4,414. При окислении 1 моль этого вещества в присутствии катализатора выделяется 2 моль СО2 и образуется дикарбоновая кислота В, способная превращаться в циклический ангидрид С, который при нагревании с аммиаком образует циклическое соединение D. Напишите уравнения реакций. 82.* При дегидрировании смеси циклогексана и циклогексена с образованием бензола выделился водород массой, достаточной для полного восстановления 36,9 г нитробензола до анилина. Найти процентный (по массе) состав исходной смеси, если известно, что такая же масса этой смеси может обесцветить 480 г 10%-ного раствора брома в CCl4.
Но предварительно необходимо определить количества веществ, по которым будут проведены расчеты искомых величин. 1. Определим m(Br2) в растворе СCl4: m(Br2) = m(раствора) × w(Br2) = 480 г × 0,1 = 48 г. 2. Из углеводородов исходной смеси с Br2 реагирует только циклогексен С6Н10 как ненасыщенное соединение. Рассчитаем m(C6Н10) по уравнению этой реакции:
n(Br2) = m(Br2) / M(Br2) = 48 г / 160 г/моль = 0,3 моль; n(С6Н10) = n(Br2) = 0,3 моль; m(C6Н10) = n(С6Н10) × M(С6Н10) = 0,3 моль × 82 г/моль = 24,6 г. 3. Определим количество вещества Н2, необходимого для восстановление нитробензола до анилина:
n(С6Н5NO2) = m(С6Н5NO2) / M(С6Н5NO2) = 36,9г / 123 г/моль = = 0,3 моль. Следовательно, n(Н2) = 3n(С6Н5NO2) = 0,9 моль. 4. Массу циклогексана найдем из уравнений реакций дегидрирования углеводородов:
Из уравнения (1) следует, что x = n(H2) = 0,6 моль. Тогда количество водорода, выделившегося в реакции (2), n(Н2) = 0,9 моль – 0,6 моль = 0,3 моль. Отсюда: n(С6Н12) = 0,3 моль / 3 = 0,1 моль; m(C6H12) = n(C6H12) × M(C6H12) = 0,1 моль × 84 г/моль = 8,4 г. 5. Определим массу исходной смеси углеводородов: m(смеси) = m(C6H12) + m(C6H10) = 8,4 г + 24,6 г = 33,0 г. 6. Рассчитаем массовые доли углеводородов в исходной смеси: w(С6Н10) = m(C6H10) / m(смеси) = 24,6 г / 33 г = 0,745 (74,5%); w(С6Н12) = m(C6H12) / m(смеси) = 8,4 г / 33 г = 0,255 (25,5%). Ответ: w(С6Н10) = 0,745 (74,5%); w(С6Н12) = 0,255 (25,5%). 83. Смесь бензола с циклогексеном массой 4,39 г обесцвечивает бромную воду массой 125 г с массовой долей брома 3,2%. Какая масса воды образуется при сжигании в кислороде той же смеси массой 10 г? 84. Углеводород состава С9Н8 обесцвечивает бромную воду, при окислении образует фталевую (бензол-1,2-дикарбоновую) кислоту, с аммиачным раствором оксида серебра дает осадок. Напишите структурную формулу углеводорода, приведите уравнения протекающих реакций. 85. Какие заместители в бензольном кольце называются ориентантами I и II рода? Приведите примеры таких заместителей и уравнения реакций, иллюстрирующих их влияние на бензольное кольцо в реакциях электрофильного замещения. 86. Объясните, почему при нитровании толуола происходит замещение атомов водорода только у 2, 4 и 6 атомов углерода, но никогда не замещаются атомы водорода у 3 и 5 атомов углерода. 87. Напишите уравнения реакций, с помощью которых можно синтезировать пара- и мета-хлорбензойные кислоты, исходя из толуола. 88. Составьте уравнения реакций, позволяющих осуществить следующие превращения:
89. Укажите условия проведения реакций и их механизмы в следующей цепи превращений:
90. Напишите уравнения реакций и структурную формулу продукта А, образующегося в результате превращений:
91. Предложите реакции, с помощью которых можно осуществить превращение н-гексана в стирол (винилбензол). 2. Кислородсодержащие соединения
2.1. Спирты. Фенолы
92. Массовые доли углерода, водорода и кислорода в спирте соответственно равны: 52,18, 13,04 и 34,78%. Выведите формулу спирта и вычислите его молярную массу. 93. При сгорании органического соединения массой 4,8 г получен оксид углерода (IV) массой 6,6 г и вода массой 5,4 г. Плотность паров вещества по водороду равна 16. Выведите формулу и назовите это вещество. 94. Газообразные продукты, образующиеся при сжигании 9,2 г органического вещества, пропустили последовательно через поглотители, содержащие Р2О5 и раствор едкого натра. При этом масса первого поглотителя возросла на 10,8 г, а во втором образовалось 10,6 г Na2CO3 и 25,2 г NaHCO3. Определите структурную формулу вещества, если оно не взаимодействует с металлическим натрием. 95. Какой одноатомный спирт был взят, если при взаимодействии 16 мл этого спирта (r = 0,8 г/мл) с металлическим натрием выделился водород в количестве, достаточном для гидрирования 4,48 л этилена (н.у.)? Решение Запишем уравнения реакций в соответствии с условиями задачи:
n(С2Н4) = V(C2Н4) / Vm = 4,48 л / 22,4 л/моль = 0,2 моль. Согласно уравнениям (1) и (2), n(ROH) = 2n(H2) = 0,4 моль m(ROH) = r(ROH) × V(ROH) = 0,8 г/мл × 16 мл = 12,8 г; M(ROH) = m(ROH) / n(ROH) = 12,8 г / 0,4 моль = 32. Значению M(ROH) = 32 отвечает формула спирта СН3ОН. Ответ: СН3ОН (метанол). 96. При дегидратации 45 г предельного одноатомного спирта неизвестного состава выделилось 8,76 г воды при 80%-ном выходе. Какова молекулярная формула спирта? Решение Вычислим теоретическую массу образовавшейся воды: m(Н2О)теор.= m(Н2О)практ. × 100% / 80% = 5,84 г × 100% / 80% = 10,95 г. Составим в общем виде уравнение дегидратации спирта:
Так как, согласно стехиометрии, n(СnH2n+1OH) = n(H2O), то будет справедливым уравнение: 45 / (14n + 18) = 10,95 / 18. Решив это уравнение, получим n = 4, т.е. формула спирта С4Н9ОН. Ответ: С4Н9ОН. 97. При межмолекулярной дегидратации 30 г одноатомного спирта неизвестного состава выделилось 3,6 г воды, причем выход продукта реакции составил 80% от теоретического. Каково строение исходного спирта, если известно, что в его молекуле имеются две метиленовые группы? 98. При сжигании предельного одноатомного спирта объем выделившегося оксида углерода (IV) в 8 раз превосходит объем водорода, выделившегося при действии избытка натрия на то же количество спирта. Определите структуру спирта, если он содержит три метильных группы. 99. При нагревании предельного одноатомного спирта массой 24 г с концентрированной серной кислотой образовался алкен массой 12,6 г. Массовая доля выхода продукта составила 75%. Определите формулу исходного спирта. 100. При взаимодействии одноатомного спирта неизвестного строения с 48%-ной бромоводородной кислотой (r = 1,5 г/мл) образовалось 49,2 г (0,4 моль) н-алкилбромида. Определите строение исходного спирта и продукта реакции. Какой объем раствора бромоводородной кислоты потребуется, если выход продукта реакции составил 75% от теоретического? 101.* Определите состав смеси метанола и этанола, если известно, что при действии избытка металлического натрия на 11 г смеси выделилось 3,36 л водорода (н.у.). 102. Метанол количеством вещества 1,5 моль нагрели с избытком бромида натрия и серной кислоты. При этом получили 57 г бромметана. Определите массовую долю выхода продукта реакции. 103. При дегидратации пропанола-2 получили пропилен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2%. Определите массу пропанола-2, взятую для реакции. 104. Какой объем 96%-ного этанола (r = 0,8 г/мл) необходим, чтобы при его дегидратации получить 0,2 моль газа, способного обесцветить бромную воду? 105. Определите массу этилового спирта, образовавшегося при брожении глюкозы, если при этом выделилось столько же углекислого газа, сколько его образуется при сгорании 20 мл метанола (r = 0,8 г/мл). 106. При взаимодействии раствора этилового спирта в гексане с металлическим натрием выделилось 4,48 л водорода (н.у.). На полное сжигание такой же массы исходного раствора расходуется 789,6 л воздуха (н.у.). Содержание кислорода в воздухе 20% по объему. Вычислите массовую долю (в %) этилового спирта в исходной смеси. 107. При нагревании 23 г этанола с концентрированной серной кислотой образовалось два органических соединения. Одно из них – газообразное – может обесцветить 40 г 40%-ного раствора брома в четыреххлористом углероде. Второе соединение представляет собой легкокипящую жидкость. Какие вещества образовались при условии, что спирт прореагировал полностью? Определите массу каждого из них. 108.* На 16,6 г смеси этилового и пропилового спиртов подействовали избытком металлического натрия. Выделившийся при этом водород смешали с 0,336 л (н.у.) аргона. Плотность полученной газовой смеси по водороду равна 10,5. Определите массовые доли каждого спирта в исходной смеси. 109. Какая масса фенолята натрия может быть получена при взаимодействии фенола массой 9,4 г с раствором гидроксида натрия объемом 9,94 мл и плотностью 1,38 г/мл? Массовая доля гидроксида натрия в растворе составляет 35%. 110. На нейтрализацию смеси фенола с этанолом затратили раствор объемом 50 мл с массовой долей гидроксида натрия 18% и плотностью 1,2 г/мл. Такая же масса смеси прореагировала с металлическим натрием массой 9,2 г. Определите массовые доли фенола и этанола в смеси. Решение Напишем уравнения реакций с учетом условий задачи:
n(Na) = m(Na) / M(Na) = 9,4 г / 23 г/моль = 0,4 моль; n(смеси) = n(Na) = 0,4 моль; m(раствора NaOH) = V(раствора) × r(раствора) = 50 мл×1,2 г/мл = 60 г; m(NaOH) = m(раствора)×w(NaOH) =60 г × 0,18 = 10,8 г; n(NaOH) = m(NaOH) / M(NaOH) = 10,8 г / 40 г/моль = 0,27 моль; Согласно уравнению (3), n(С6Н5ОН) = n(NaOH) = 0,27 моль; n(С2Н5ОН) = 0,4 – 0,27 = 0,13 моль; m(C2Н5ОН) = n(С2Н5ОН)×М(С2Н5ОН) = 0,13 моль×46 г/моль = 5,98г; m(C6Н5ОН) = n(С6Н5ОН)×М(С6Н5ОН) = 0,27 моль×94 г/моль = 25,38 г; m(смеси) = 5,98 г + 25,38 г = 31,36 г; w(С2Н5ОН) = 5,98 г / 31,36 г = 0,1907 (19,07%); w(С6Н5ОН) = 100% – 19,07% = 80,93%. Ответ: w(С2Н5ОН) = 19,07%; w(С6Н5ОН) = 80,93%. 111. Для нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40%-ного раствора КОН (r = 1,4 г/мл). При обработке такой же массы исходной смеси металлическим натрием выделилось 6,72 л газа (н.у.). Определите массовую долю этилового спирта в исходной смеси. 112. Какой объем (мл) 9,4%-ного раствора фенола в бензоле (r = 0,9 г/мл) должен прореагировать с натрием, чтобы выделившегося водорода хватило на полное каталитическое гидрирование 1,12 л (н.у.) ацетилена? 113. Вещество состава С8Н10О реагирует с натрием и гидроксидом натрия, а при действии бромной воды превращается в вещество состава С8Н7Br3О. Назовите это вещество, приведите уравнения перечисленных реакций. 114. В четыре пробирки, содержащие одинаковые объемы подкисленного водного раствора дихромата калия К2Сr2О7, добавили по 1 мл изомерных бутиловых спиртов. Пробирки нагрели на водяной бане. Что при этом наблюдалось? В чем сходство и различие процессов, происходящих в пробирках? Составьте уравнения реакций, подберите коэффициенты методом электронного баланса. РешениеФормуле бутиловых спиртов С4Н9ОН соответствуют 4 изомера: два первичных спирта (бутанол-1 и 2-метилпропанол-1), один вторичный (бутанол-2) и один третичный (2-метилпропанол-2). Первичные, вторичные и третичные спирты по-разному ведут себя в реакциях окисления (часть III, разделы 2.5.1.3 и 2.5.5). Легче всего окисляются первичные спирты, превращаясь при этом в альдегиды и затем в кислоты. В пробирках, содержащих бутанол-1 (н-бутиловый спирт) и 2-метилпропанол-1 (изобутиловый спирт), изменение оранжевого цвета раствора на зеленый (за счет восстановления ионов Сr2O72- до Cr3+) происходит почти мгновенно.
Содержимое пробирки с бутанолом-2 (втор-бутиловым спиртом) также приобретает зеленую окраску, но несколько медленнее. При этом вторичный спирт (бутанол-2) окисляется до кетона (бутанона):
Различие между первичными и вторичными спиртами в реакции с таким довольно сильным окислителем, как дихромат калия+H2SO4, проявляется не очень ярко. В пробирке с 2-метилпропанолом-2 (трет-бутиловым спиртом) (CH3)3C-OH, даже при нагревании оранжевая окраска не изменится, поскольку в этих условиях третичные спирты не окисляются. 115. Образец фенолята натрия разделили на две части. Одну часть растворили в абсолютном (безводном) этаноле, вторую – в дистиллированной воде. К каждому из растворов добавили равное число капель спиртового раствора фенолфталеина. Опишите и объясните наблюдения экспериментаторов. 116. Промежуточным соединением в реакциях внутри- и межмолекулярной дегидратации этилового спирта является этилсульфат. Напишите уравнение реакции его образования из этанола и концентрированной серной кислоты, а также схемы дальнейшего превращения в диэтиловый простой эфир и этен. По каким механизмам протекают эти реакции? 117. Предложите способ синтеза трет-бутилового спирта (2-метилпропанола-2), используя в качестве органических реагентов только этанол и продукты его превращений, а также любые неорганические реагенты. 118. Два гидроксильных производных углеводородов – гексанол-1 и фенол – можно легко различить с помощью раствора щелочи. Запишите структурные формулы этих веществ. Объясните, на каких свойствах этих веществ основан этот способ идентификации. 119. Рассмотрите возможность взаимодействия фенола и этилового спирта с металлическим натрием и раствором гидроксида натрия. Напишите соответствующие уравнения реакций. Объясните отличие химических свойств фенола и этилового спирта. 120. Из двух изомерных спиртов состава С5Н12О в результате дегидратации образуется один и тот же алкен. Окисление последнего приводит к смеси пропанона и этановой кислоты. Установите строение спиртов и напишите уравнения происходящих при этом реакций. 121. Напишите уравнения реакций с указанием условий их проведения для следующих превращений:
122. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
123. Расшифруйте следующую цепь превращений, назовите вещества А, Б, В и Г, напишите структурные формулы и уравнения реакций:
124. Напишите структурные формулы соединений, образующихся в приведенной цепочке превращений:
125. Составьте уравнения реакций для цепи превращений:
2.2. Альдегиды и кетоны
126. При окислении 100 мл метилового спирта (r = 0,8 г/мл) было получено 120 мл 3%-ного раствора формальдегида (r = 1 г/мл). Определите массовую долю выхода продукта реакции. Решение 1. Определим массу метилового спирта и его количество: m(CH3OH) = V(CH3OH) × r(CH3OH) = 100 мл × 0,8 г/мл = 80 г; n(СН3ОН) = m(CH3OH) / M(CH3OH) = 80 г / 32 г/моль = 2,5 моль. 2. Определим массу формальдегида в растворе: m(CH2O) = V(р-ра) × r(р-ра) × w(СН2О) = 120 мл × 1 г/мл × 0,03 = 3,6 г. 3. Составим уравнение реакции окисления метилового спирта и воспользуемся стехиометрией для дальнейших вычислений:
n(СН2О) = n(СН3ОН) = 2,5 моль; m(CH2O)теор. = n(CH2O) × M(CH2O) = 2,5 моль × 30 г/моль = 75 г; w(выхода) = m(практ.) / m(теор.) = 3,6 г / 75 г = 0,048 (4,8%). Ответ: w(выхода) = 4,8%. 127. Вычислите массу ацетилена, необходимую для получения ацетальдегида массой 5,5 г по реакции Кучерова. Массовая доля выхода продукта реакции составляет 95%. 128. Какой объем займет при н.у. формальдегид, который нужно растворить в воде для получения 1 л формалина (40%-ный раствор, r = 1,11 г/мл)? 129. Какой объем 20%-ного раствора формальдегида (r = 1,06 г/мл) надо добавить к аммиачному раствору оксида серебра, чтобы получить 21,6 г металлического серебра? 130. Какого состава соль образуется и какова ее концентрация в растворе, полученном при растворении в 76,8 мл 28%-ного раствора едкого кали (r = 1,3 г/мл) продуктов реакции, образовавшихся при сжигании 9,7 г пропаналя? 131. При действии на 15 г смеси этана, формальдегида и фенола аммиачным раствором оксида серебра получили 21,6 г металлического серебра. При действии на такое же количество смеси бромной водой получили 33,1 г белого осадка. Определите состав исходной смеси (по массе). 132.* Смесь формальдегида и ацетальдегида массой 0,74 г обработали аммиачным раствором оксида серебра при нагревании. При этом образовался осадок массой 6,48 г. Определите массы компонентов исходной смеси. 133. Какая масса ацетальдегида образовалась при окислении этанола (массовая доля выхода 75%), если известно, что при взаимодействии такой же массы спирта с натрием выделился водород объемом 11,2 л (н.у.)? 134. Смесь массой 10,5 г, состоящая из спирта (w = 17,1%) и альдегида (w = 82,9%), реагирует с оксидом серебра массой 34,8 г. Сколько атомов углерода в молекуле спирта, если их число такое же, что и в молекуле альдегида? 135. Запишите уравнения реакций, с помощью которых можно синтезировать ацетон, используя ацетилен в качестве единственного органического соединения. 136. Вещество состава С3Н6О2 взаимодействует с аммиачным раствором оксида серебра и металлическим натрием. Его можно получить трехстадийным синтезом из пропанола-1. Определите строение вещества, предложите схему его получения. 137. В промышленности некоторое органическое вещество получают каталитическим окислением пропена (катализатор – МоО3). 1 моль этого вещества присоединяет 1 моль брома, при нагревании с гидроксидом меди (II) образует осадок красно-бурого цвета. Газообразный хлороводород присоединяется к данному органическому веществу против правила Марковникова. Что это за вещество? Напишите уравнения упомянутых реакций. Объясните причину нарушения правила Марковникова. 138. Расшифруйте приведенную схему превращений, указав строение и названия продуктов, полученных на каждой стадии.
139. Напишите уравнения реакций для цепи превращений:
140. Укажите условия для осуществления превращений:
141. Укажите реагенты для всех стадий в цепочке превращений:
2.3. Карбоновые кислоты и их производные
142. К одноосновной карбоновой кислоте массой 42 г прибавили раствор гидроксида натрия объемом 36,3 мл (r = 1,1 г/мл) с массовой долей NaOH 20%, а затем избыток раствора гидрокарбоната калия, при этом выделился газ объемом 11,2 л (н.у.). Какая была взята кислота? 143. На нейтрализацию смеси муравьиной и уксусной кислот затрачен раствор гидроксида калия массой 200 г с массовой долей щелочи 11,2%. При действии на такую же массу смеси аммиачным раствором оксида серебра выделилось серебро массой 2,16 г. Какова массовая доля уксусной кислоты в смеси? 144. При окислении 5,8 г альдегида образовалась со 100%-ным выходом кислота, на нейтрализацию которой потребовалось 18,2 мл 20%-ного раствора гидроксида натрия плотностью 1,1 г/мл. Какой альдегид был окислен? 145. Определите состав и строение одноосновной карбоновой кислоты, если известно, что для нейтрализации 4,8 г ее требуется 16,95 мл 22,4%-ного раствора едкого кали (r = 1,18 г/мл). 146. Можно ли растворить в уксусной кислоте 2 г известняка, если к 200 мл 10%-ного раствора ее (r = 1,104 г/мл) прилить 100 г 5%-ного раствора гидроксида натрия? Ответ подтвердите расчетом. 147. При взаимодействии 35,55 мл 30%-ного раствора (r = 1,04 г/мл) одноосновной органической кислоты неизвестного строения с избытком гидрокарбоната натрия выделилось 3,36 л газа (н.у.). Определите строение исходной органической кислоты. 148. При окислении 5,75 г кислородсодержащего органического соединения неизвестного строения образовалась уксусная кислота. Для полной нейтрализации газа, полученного при полном сжигании этой кислоты, потребовалось 80 мл 28%-ного раствора гидроксида калия (r = 1,25 г/мл). Какое вещество взято для окисления? Какая масса уксусной кислоты при этом образовалась? 149. При взаимодействии 50 г смеси водных растворов фенола и уксусной кислоты с бромной водой выпало 33,1 г белого осадка. Для реакции с таким же количеством смеси потребовалось 139,1 мл 10%-ного раствора едкого натра (r = 1,15 г/мл). Какова массовая доля уксусной кислоты в исходной смеси? 150. 30,9 г смеси уксусной кислоты, этилового спирта и уксусного альдегида последовательно обработали водным раствором гидрокарбоната натрия (при этом выделилось 11,2 л газа при н.у.), затем аммиачным раствором оксида серебра (при этом образовалось 2,16 г осадка). Определите массовые доли этилового спирта и уксусного альдегида в исходной смеси. 151. 37 г неизвестной предельной одноосновной органической кислоты нейтрализовали водным раствором питьевой соды. При пропускании выделившегося газа через известковую воду выпало 50 г осадка. Какая кислота была взята и каков объем (н.у.) выделившегося газа? Растворимостью газа в воде пренебречь. 152.* Свежеприготовленная смесь пропилового спирта и пропионовой кислоты может прореагировать со 100 мл 4,04%-ного раствора гидрокарбоната натрия (r = 1,04 г/мл). Выделившийся при этом газ занимает в 18 раз меньший объем, чем тот же газ, образующийся при полном сгорании такого же количества исходной смеси (объемы газов измерены при одинаковых условиях). Вычислите массу исходной смеси спирта и кислоты и массовые доли каждого компонента в ней. 153. Какие вещества называются функциональными производными карбоновых кислот? Приведите названия и общие формулы этих соединений, а также уравнения реакций взаимопревращений карбоновых кислот и их функциональных производных. 154. Сколько граммов уксусного альдегида потребуется для получения трехстадийным синтезом 55 мл этилацетата (r = 0,8 г/мл), если все реакции будут протекать со 100%-ным выходом? 155.* Для гидролиза 5,6 г смеси этиловых эфиров уксусной и муравьиной кислот потребовалось 25,96 мл 10%-ного раствора едкого натра (r = 1,08 г/мл). Определите массовые доли каждого компонента в смеси. 156. Имеется смесь метанола и пропановой кислоты. При нагревании этой смеси в присутствии серной кислоты получили эфир массой 13,2 г. На нейтрализацию такого же образца смеси затратили 40 г раствора щелочи с массовой долей NaOH 20%. Найдите массовые доли компонентов в смеси. 157. При нагревании смеси этанола и уксусной кислоты в присутствии серной кислоты получили этилацетат массой 13,2 г. Выход эфира (по массе) составил 60%. При действии избытка гидрокарбоната натрия на исходную смесь такой же массы образовался газ объемом 7,84 л (н.у.). Определите массовые доли веществ в смеси. 158. Какая масса жира потребуется для получения 46 г глицерина, если считать, что жир – чистейший триолеат и что при нагревании его с водой в соответствующих условиях удается расщепить только 80% жира? Какой объем 10%-ного раствора гидроксида натрия (r = 1,1 г/мл) потребуется для превращения образующейся кислоты в мыло и какая масса мыла при этом получится? 159. Сколько граммов жира, содержащего 81% тристеарата глицерина, потребуется для двухстадийного синтеза 45,4 г нитроглицерина при условии, что все превращения протекают количественно? 160. При производстве мыла из жира с выходом 85% получено 7898,2 кг глицерина. Какая масса жира была использована для производства, если одна из спиртовых групп глицерина была этерифицирована пальмитиновой кислотой, а остальные бутановой? 161. Как считали самые знаменитые химики ХIX века, органические вещества нельзя получить из неорганических. Опровергните это мнение, написав уравнения реакций, с помощью которых можно получить уксусную кислоту из мрамора. Укажите условия осуществления каждой реакции. 162. Составьте уравнения реакций для следующих превращений:
163. Напишите уравнения реакций для цепочки превращений:
164. Запишите уравнения реакций для данной схемы превращений:
165. Укажите реагенты для осуществления взаимопревращений:
2.4. Углеводы
166. Сколько граммов глюкозы потребуется для получения из нее этилового спирта брожением, если известно, что при нагревании полученного спирта с концентрированной серной кислотой образуется 10 мл диэтилового эфира (r = 0,925 г/мл), что составляет 50% от теоретически возможного выхода? Решение 1. Определим практическую массу эфира: m(эфира) = V(эфира) × r(эфира)= 10 мл × 0,925 г/мл = 9,25 г. 2. Определим теоретическую массу и количество вещества эфира: m(эфира)теор. = 9,25 г × 100% / 50% = 18,5 г; n(эфира) = 18,5 г / 74 г/моль = 0,25 моль. 3. Запишем уравнения реакций в соответствии с условиями задачи:
4. Согласно уравнениям (1) и (2), n(С6Н12О6) = n(эфира) = 0,25моль; m(С6Н12О6) = 0,25 моль×180 г/моль = 45 г. Ответ: m(С6Н12О6) = 45 г. 167. В результате ферментативного молочнокислого брожения 330 г глюкозы образовалась молочная кислота, при взаимодействии которой с карбонатом натрия выделилось 3,36 л (н.у.) газа. Определите массовую долю выхода молочной кислоты. 168. 90 г глюкозы было подвергнуто спиртовому брожению. Массовая доля выхода продукта реакции составила 90%. Образовавшийся спирт окислили в кислоту с количественным выходом. Какая масса 32%-ного раствора едкого натра потребуется для нейтрализации полученной кислоты? 169. Вычислите массу сахарозы, подвергшуюся гидролизу, с учетом того, что из образовавшейся глюкозы получена молочная кислота массой 54 г при массовой доле выхода 60%. 170. Определите массу этилового спирта, образовавшегося при брожении глюкозы, если при этом выделилось столько же углекислого газа, сколько его образуется при сгорании 20 мл метанола (r = 0,8 г/мл). 171. Одним из способов получения этилового спирта в промышленности является брожение продуктов, полученных в результате гидролиза крахмала и целлюлозы. Определите выход этилового спирта в процентах от теоретически возможного, если известно, что из 1 т картофеля, содержащего 20% крахмала, получено 100 л спирта (r = 0,8 кг/л). Решение 1. Определим массу крахмала в картофеле. m(крахмала) = m(картофеля) × w(крахмала) = 1000кг × 0,2 = 200 кг. 2. Определим практическую массу спирта. m(C2Н5ОН)практ. = V(С2Н5ОН)практ. × r(С2Н5ОН) = 100 л × 0,8 кг/л = 80 кг. 3. Составим уравнения реакций гидролиза полисахаридов и брожения образовавшихся моносахаридов и проведем стехиометрические расчеты.
При расчете учитываем молярную массу элементарного звена полисахарида. Согласно стехиометрии реакций (1) и (2), n(С2Н5ОН) = 2n(полисахарида) = 2 × 200 кг / 162 кг/моль = 2,47 моль. m(С2Н5ОН)теор. = n(С2Н5ОН) × М(С2Н5ОН) = 2,47 моль × 46 кг/моль = 113,58 кг. 4. Определим массовую долю выхода спирта. w(выхода) = m(практ.) / m(теор.) = 80 кг / 113,58 кг = 0,70 (70%). Ответ: w(выхода) = 0,70 (70%). 172. На гидролизном заводе при "осахаривании" древесных опилок и последующем брожении глюкозы получают за сутки 50 кг 96%-ного спирта. Вычислите, какая масса глюкозы (при 80%-ном использовании) подвергается брожению. Какой объем углекислого газа выделяется при этом (н.у.)? 173. При гидролизе 324 г крахмала получена глюкоза (выход = 80%), которую подвергли спиртовому брожению. В результате получили 600 г раствора спирта. Вычислите массовую долю этанола в растворе, учитывая, что выход этанола в реакции брожения составил 75% от теоретического. 174. Энергетическую ценность пищевого продукта принято оценивать его теплотой сгорания и выражать в кДж/г (ккал/г). Вычислите калорийность глюкозы, химическое превращение которой в организме человека приводит к образованию воды и углекислого газа. Стандартные молярные теплоты образования СО2, Н2О и глюкозы в кДж/моль, соответственно, равны 393,5, 285,8, 1273. (В единицах СИ 1 ккал = 4,184 кДж). 175. Составьте схему получения бензола из целлюлозы. Запишите уравнения реакций с указанием условий их проведения. 176. Напишите уравнения реакций для приведенной цепочки превращений:
177. Предложите путь синтеза, соответствующий схеме: целлюлоза ® ПВХ (поливинилхлорид). 178. Укажите условия проведения реакций по следующей схеме:
3. Азотсодержащие соединения
179. Определите массу нитробензола, полученного из бензола массой 312 г, если массовая доля выхода составляла 92%. 180. Какой объем раствора азотной кислоты (r = 1,15 г/мл) с массовой долей НNО3 25% требуется для нитрования бензола массой 156 г? 181. Через 10 г смеси бензола, фенола и анилина пропустили ток сухого хлороводорода, при этом выпало 2,59 г осадка. Его отфильтровали, а фильтрат обработали водным раствором гидроксида натрия. Верхний органический слой отделили, его масса уменьшилась на 4,7 г. Определите массы веществ в исходной смеси. 182. Массовые доли углерода, азота и водорода в первичном амине составляют соответственно 3,78, 45,15 и 16,15%. Определите формулу амина и вычислите его молярную массу. 183. Какая масса анилина может быть получена из нитробензола массой 369 г, если массовая доля выхода продукта составляет 95%? 184. Через смесь бензола, фенола и анилина массой 20 г пропустили хлороводород. При этом выпал осадок массой 2,59 г. При нейтрализации такой же массы смеси затрачен раствор щелочи массой 10 г с массовой долей NаОН 20%. Какова массовая доля бензола в смеси? 185. Вычислите массу осадка, образовавшегося при взаимодействии анилина массой 279 г с бромной водой, содержащей 120 г брома. 186. Смесь пропана и метиламина общим объемом 11,2 л (н.у.) сожгли в токе кислорода. Продукты сгорания пропустили через известковую воду и получили при этом 80 г осадка. Определите объемные доли газов в исходной смеси и объем израсходованного кислорода. 187. При нитровании 31,2 г ароматического углеводорода образовалось единственное мононитропроизводное, которое восстановили железом в кислой среде и получили вещество (выход 60%), способное полностью поглотить газ, выделяющийся при действии избытка концентрированной серной кислоты на 14,04 г хлорида натрия. Определите молярную массу и строение исходного углеводорода. Решение Составим уравнения реакций с учетом условий задачи.
n(NaCl) = m(NaCl) / M(NaCl) = 14,04 г / 58,5 г/моль = 0,24 моль. Из уравнения (4): n(HCl) = n(NaCl) = 0,24 моль. Согласно уравнению (3), n(СnH2n-5NH2)теор. = n(HCl) = 0,24 моль; n(CnH2n-5NH2)практ. = 0,24 моль × 100% / 60% = 0,4 моль. Из уравнений (1) и (2) находим: n(CnH2n-6) = n(CnH2n-5NH2) = 0,4 моль; М(CnH2n-6) = m(CnH2n-6) / M(CnH2n-6) = 31,2 г / 0,4 моль = 78 г/моль. С другой стороны, М(CnH2n-6) = 14n - 6. Решая уравнение 14n - 6 = 78, получаем n = 6. Следовательно, формула ароматического углеводорода С6Н6 (бензол). Ответ: М(С6Н6) = 78 г/моль. 188. При нитровании 15,6 г бензола смесью концентрированных азотной и серной кислот было получено с выходом 90% мононитропроизводное, которое далее было восстановлено до соответствующего амина с выходом 75%. Сколько миллилитров этого амина получено, если его плотность 1,02 г/мл? 189. Вычислите массу бензола, необходимого для получения 33 г 2,4,6-триброманилина трехстадийным способом, если известно, что выход на последней стадии количественный, а на двух предыдущих по 50%. 190.* При восстановлении нитробензола железом в соляной кислоте получили анилин. Отогнанный с водяным паром анилин оказался загрязненным нитробензолом. Для количественного определения примеси нитробензола 1/25 часть полученного анилина сожгли. Газообразные продукты сгорания поглотили избытком концентрированного раствора КОН. При этом не поглотилось 0,448 л газа (н.у.). Равную порцию полученного анилина обработали 25 мл 20%-ного раствора серной кислоты (r = 1,14 г/мл); в результате образовалось 6,88 г осадка. Рассчитайте массу полученного анилина и массовую долю нитробензола в нем. 191. На смесь уксусной и аминоуксусной кислот массой 27 г подействовали раствором соляной кислоты массой 100 г с массовой долей HCl 7,3%. Вычислите массу гидроксида калия, необходимого для полной нейтрализации взятой смеси. 192. Смесь аланина и уксусной кислоты массой 200 г обработали раствором соляной кислоты объемом 200 мл (r = 1,047 г/мл) с массовой долей HCl 10%. Какова массовая доля аланина в смеси? 193. Используя правила ориентации, укажите, какие реакции следует осуществить, чтобы получить из бензола все изомерные нитробромбензолы. 194. Какое из оснований сильнее: аммиак или диметиламин? Объясните, почему. Приведите уравнения реакций, подтверждающих оснóвные свойства этих соединений. 195. Сравните по основности анилин, п-толуидин (1-амино-4-метилбензол) и п-нитроанилин. Запишите уравнения реакций синтеза наиболее сильного основания на основе бензола. 196. Какая из кислот: бензойная, п-хлорбензойная или п-аминобензойная – будет обладать наибольшей кислотностью? Почему? Запишите уравнения реакций получения данной кислоты, исходя из толуола. 197. Каким образом, используя нитрит натрия и соляную кислоту, можно различить водные растворы метиламина, диметиламина и триметиламина? Напишите уравнения реакций, укажите визуальный эффект. Решение Для идентификации первичных, вторичных и третичных аминов используется азотистая кислота HNO2 (часть IV, раздел 6.3.2). Это неустойчивое соединение применяют непосредственно в момент выделения в реакции ионного обмена: NaNO2 + HCl ® HNO2 + NaCl 1. Метиламин (первичный амин) реагирует с HNO2 с выделением пузырьков газа – азота: CH3NH2 + HO-N=O ® CH3OH + N2 + H2O 2. Диметиламин (вторичный амин) образует маслообразное вещество желтого цвета (диметилнитрозоамин), плохо растворимое в воде: (CH3)2NH + HO-N=O ® (CH3)2N-N=O¯ + H2O 3. Триметиламин (CH3)3N (третичный алифатический амин) в аналогичных условиях с азотистой кислотой не взаимодействует. 198. Напишите уравнения реакций, протекающих в цепочке превращений:
199. Составьте уравнения реакций, с помощью которых осуществляются следующие превращения:
200. Приведите уравнения реакций, позволяющих получить N,N-диметиланилин, исходя из метана. Укажите их условия. 201. Напишите уравнения реакций для цепочки превращений:
4. Высокомолекулярные соединения
202. Какова средняя молекулярная масса полипропилена, если N его макромолекул имеют степень полимеризации 2000, 2N макромолекул – 5000 и 3N – 6000? Решение 1. Находим среднюю (по числу макромолекул) степень полимеризации полипропилена.
2. Вычисляем среднюю (числовую) молекулярную массу полимера: Mr (ср.) (полипропилена) = nср. × Mr(C3H6) = 5000 × 42 = 210000. Ответ: Мr (ср.) (полипропилена) = 210000. 203. Определите среднюю степень полимеризации поливинилхлорида, который содержит 30% (от общего числа) макромолекул с молекулярной массой 187500. Молекулярная масса остальных макромолекул равна 312500. 204. Для получения лавсана взяли 6,2 г этиленгликоля и 18,26 г терефталевой кислоты. Рассчитайте максимально возможную молекулярную массу этого полимера. 205. Сополимер стирола и винилхлорида содержит 9,5% хлора (по массе). Определите, сколько звеньев стирола приходится на одно звено винилхлорида в макромолекулах этого сополимера. Решение Строение макромолекул сополимера можно представить в виде:
Допустим, что 1 моль сополимера содержит х моль звеньев стирола. Тогда количество звеньев винилхлорида в этом сополимере будет равно (1 – х) моль. М(С8H8) = 104 г/моль; М(С2H3Сl) = 62,5 г/моль. m(С8H8) = 104 x г; m(С2H3Сl) = 62,5(1 – х) г. Определим массовую долю хлора в звене винилхлорида: w(Cl) = 35,5 г / 62,5 г = 0,568. Отсюда находим массу хлора в 1 моль сополимера и массу этого сополимера: m(Cl) = 0,568 × 62,5(1 - x) г = (35,5 - 35,5x) г; m(сополимера) = 104х г + 62,5(100 - x) г = = (41,5х + 62,5) г. Составим уравнение для вычисления х = n(С8H8), учитывая, что по условию задачи массовая доля хлора в сополимере равна 0,095 (9,5%):
Решая это уравнение относительно х, получаем n(С8H8) = 0,75 моль и, соответственно, n(С2H3Сl) = 0,25 моль. Отсюда мольное соотношение звеньев n(С8Н8) : n(С2Н3Сl) = 3 : 1. Таким образом, в данном сополимере на 1 звено винилхлорида приходится 3 звена стирола. Ответ: 3 звена. 206. Масло- и бензостойкий каучук марки СКН-40 представляет собой сополимер бутадиена и акрилонитрила (CH2=CH-CN), содержащий 40% (по массе) акрилонитрильных звеньев. Выразите мольное соотношение мономерных звеньев в этом сополимере в виде целых чисел. 207. При термическом разложении сополимеров винилхлорида и этилена выделяется хлороводород. Определите состав одного из таких сополимеров (в мольных долях), если при разложении его образца массой 2,37 г выделился хлороводород, для нейтрализации которого потребовалось 22,4 г 5%-ного раствора КОН. 208. Какие реакции нужно осуществить для получения полиакриловой кислоты [-CH2-CH(COOH)-]n из метана? 209. Поливинилацетат [-CH2-CH(ОCOСH3)-]n является основой известного клея ПВА. Предложите схему его получения, исходя из метана. 210. Напишите формулы и названия соединений, образующихся в данной цепи превращений:
211. Напишите уравнения реакций для приведенной схемы превращений:
Назовите все соединения и укажите области практического применения продукта Х4. 212. Исходя из бензола, предложите схему получения полимера кевлар (высокопрочный материал, используется для изготовления деталей крыльев самолетов, пуленепробиваемых жилетов и т.п.):
|
|
Углеводороды. Алканы. Циклоалканы 1. С7Н8. 2. С6Н12. 3. С3Н6. 4. Молекулярная формула алкана С3Н8. 5. С5Н12; 3 изомера. 6. С6Н14. 7. С3Н8. 8. С3Н8. 9. С3Н8. 10. V(воздуха)=10,7 л. 11. m(NаНСО3)=16,8 г. 12. V(С12)=40,32 л. 13. ω(выхода)=86,2%. 14. ω(С2Н6)=54%; ω(С3Н8)=46%. 15. V(смеси)=55,3 л. 16.ω(выхода)=77%. 17. V(раствора)=218,2 мл. 18. m(СН3Cl)=50,5 г; m(СН2Cl2)=170 г; m(CНCl3)=358,5 г. 19. ω(С2Н6)=67%; ω(С3Н6)=33%. 20. φ(СН4)=φ(N2)=50%. 21. φ(СН4)=75%; φ(С3Н8)=25%. 22. φ(С3Н8)=43,8%. 23. ν(С2Н4)=0,1 моль; ν(С3Н8)=0,2 моль. 24. ν(СН4)=0,1 моль. 25.φ(С3Н8)=0,88%; φ(С4Н10)=99,12%. 26. С6Н12, циклогексан. 27. m(NaHCO3)=50,4 г. Алкены. Алкадиены Алкины Ароматические углеводороды Кислородсодержащие соединения Альдегиды и кетоны Карбоновые кислоты и их производные Углеводы Азотсодержащие соединения Высокомолекулярные соединения |