Молярная масса
Для отдельных химических элементов молярной массой является масса одного моля атомов этого элемента. При этом молярная масса элемента, выраженная в г/моль (кг/моль), численно совпадает с относительной атомной массой ArAr – безразмерная величина этого элемента.
Молярная масса вещества равна сумме молярных масс элементов, входящих в состав его молекул.
Например, молярная масса метана CH4 определяется следующим образом:
Это означает, что 16 г CH4 содержат 6,02·1023 молекул (1 моль).
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
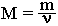
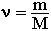
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, то есть зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные
- Пример
Вычислить массы метана CH4 и этана С2H6, взятых в количестве
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12 + 6 = 30 г/моль.
Отсюда:
m(CH4) = 2 моль • 16 г/моль = 32 г;
m(С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, так как частицы вещества (атомы и молекулы) не одинаковы по массе.
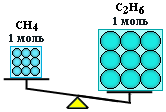
ν(CH4) = ν(С2Н6), но m(CH4) < m(С2Н6)








