Водородные связи и физические свойства
Следствием полярности связи О–НОδ–— Нδ+ и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию межмолекулярных водородных связей (часть I. Водородные связи).
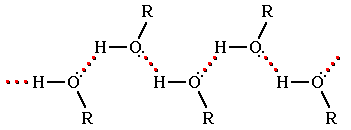
Ассоциация молекул ROH
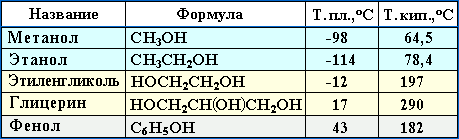
Это объясняет почему даже низшие спирты – жидкости с относительно высокой температурой кипения (т.кип. метанола
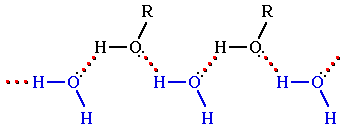
Гидратация молекул ROH
Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена (8,2% при 15°С).
Легкокипящие спирты огнеопасны. Метанол, этиленгликоль и фенолы относятся к высокотоксичным веществам.
 Видеоопыт "Физические свойства одноатомных спиртов".
Видеоопыт "Физические свойства одноатомных спиртов".








