- С—ОН с отщеплением ОН-группы,
- О—Н с отщеплением водорода.
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
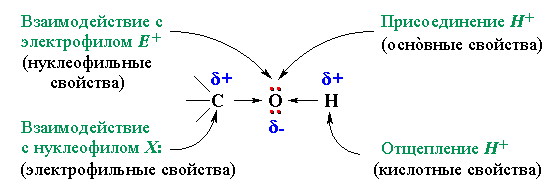
Полярный характер связей
соединения отщеплять протон (Н+). свойства гидроксисоединения, а при разрыве связи
способное присоединять
протон (Н+). и нуклеофилаНуклеофил – частица (анион или молекула), имеющая неподеленную пару электронов на внешнем электронном уровне и способная предоставить эту пару на образование ковалентной связи (по донорно-акцепторному механизму).. Пониженная электронная плотность на атоме углерода в связи С–О облегчает ее разрыв в реакциях с нуклеофильными реагентами (электрофильные свойства).
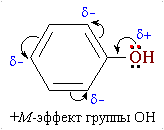
Для фенолов характерны реакции электрофильного замещения в бензольном кольце, направление которых определяется влиянием ОН-группы.
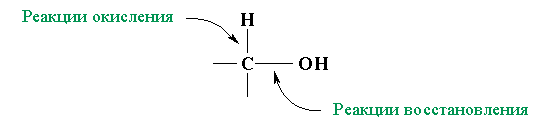
 Реакции окисления и восстановления фенолов идут также с участием ароматического радикала.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, образуя соединения различных классов. Вследствие доступности гидроксильных соединений каждая из этих реакций является одним из лучших способов получения разнообразных органических соединений.
Реакции окисления и восстановления фенолов идут также с участием ароматического радикала.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, образуя соединения различных классов. Вследствие доступности гидроксильных соединений каждая из этих реакций является одним из лучших способов получения разнообразных органических соединений.








