Функциональные производные карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность. В результате реакций по карбоксильной группе они образуют функциональные производные, а в реакциях по углеводородному радикалу — замещённые карбоновые кислоты, содержащие наряду с карбоксильной группой другую функциональную группу (
Функциональные производные карбоновых кислот — это соединения, в которых карбоксильная группа СООН преобразована в другую функциональную группу, и которые при гидролизе образуют соответствующую кислоту.
Функциональные производные монокарбоновых кислот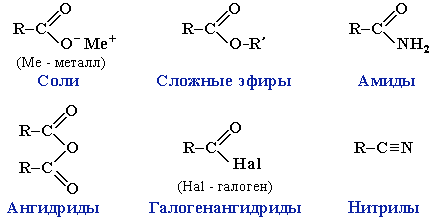
-
Соединения, содержащие группу ацил R–C(O)–
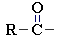 , называются ацильными производными (сложные эфиры, амиды, ангидриды, галогенангидриды).
, называются ацильными производными (сложные эфиры, амиды, ангидриды, галогенангидриды). - Нитрилы R–C≡N относят к производным карбоновых кислот, так как при гидролизе они превращаются в соответствующие кислоты.
- Многоосновные кислоты образуют два ряда функциональных производных: средние — продукты превращения всех СООН-групп и кислые, в которых сохраняется хотя бы одна карбоксильная группа.
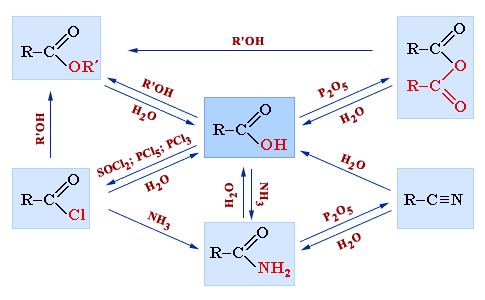
Карбоновые кислоты и их функциональные производные находятся в тесной взаимосвязи друг с другом. На схеме показаны возможные пути их взаимопревращений:
Соединения R–CO–Z (ацильные производные) вступают в реакции нуклеофильного замещения при sp2-атоме углерода по схеме:
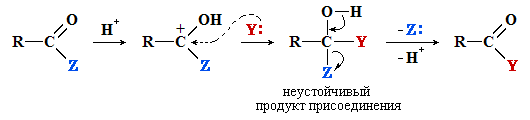
где Y: – нуклеофил; Z = OH, OR, OCOR, Cl, NH2, NHR и т.п.
Используя этот подход, можно сравнить активность при нуклеофильном замещении следующих соединений: RCOOH (кислоты), RCOOR' (сложные эфиры), RCONH2 (амиды), (RCO)2O (ангидриды) и RCOCl (хлорангидриды).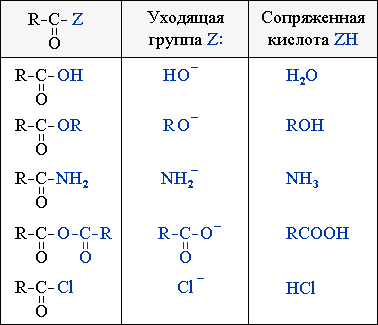
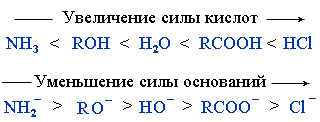
RCONH2 < RCOOR' < RCOOH < (RCO)2O < RCOCl
Наибольшей активностью обладают хлорангидриды RCOCl и ангидриды (RCO)2O. С их помощью можно получать другие ацильные производные.

где Y: – нуклеофил; Z = OH, OR, OCOR, Cl, NH2, NHR и т.п.
- По отношению к нуклеофильным реагентам, содержащим подвижный атом водорода (спирты, фенолы, амины и т.п.), взаимодействие с ацильными производными
Используя этот подход, можно сравнить активность при нуклеофильном замещении следующих соединений: RCOOH (кислоты), RCOOR' (сложные эфиры), RCONH2 (амиды), (RCO)2O (ангидриды) и RCOCl (хлорангидриды).

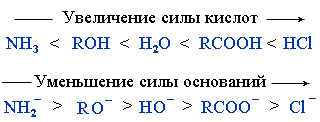
- В отличие от карбоновых кислот и их производных, альдегиды R–CH=O и кетоны R2C=O не способны к нуклеофильному замещению, поскольку уходящие группы Н:– (гидрид-ион) и R:– (карбанион) — исключительно сильные основания (их сопряженные кислоты, соответственно H2 и RH, не являются кислотами). Поэтому при действии нуклеофильных реагентов альдегиды и кетоны вступают в реакции нуклеофильного присоединения по связи С=О.
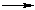 R–COOH + HZ
R–COOH + HZR–CO–Z + HO–
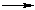 R–COO– + HZ
R–COO– + HZГидролиз соединений R–CO–Z — нуклеофильное замещение группы Z на гидроксил ОН. При кислотном гидролизе нуклеофилом является молекула Н2О с неподелённой электронной парой на атоме кислорода. В условиях щелочного гидролиза нуклеофилом служит анион НО–.
Лёгкость гидролиза функциональных производных карбоновых кислот возрастает в ряду:








