Ангидриды. Галогенангидриды
Ангидриды RCO–O–COR' — функциональные производные карбоновых кислот RCOOH, в которых гидроксильная группа Ангидриды RCO–O–COR (простые ангидриды) можно рассматривать как продукты, образующиеся при отщеплении одной молекулы воды от двух молекул одноосновной карбоновой кислоты. Смешанные ангидриды RCO-O-COR' — продукты отщепления молекулы воды от молекул двух разных кислот.
Известным представителем ангидридов карбоновых кислот является ангидрид уксусной кислоты:

Структурная формула и модель молекулы
(HCO)2O – муравьиный (метановый) ангидрид,
(CH3CO)2O – уксусный (этановый) ангидрид,
(C6H5CO)2O – бензойный ангидрид,
(CH3CH2CH2CH2CH2CO)2O – гексановый ангидрид.
Ангидриды кислот (R–CO)2О образуются при нагревании кислот с водоотнимающими реагентами: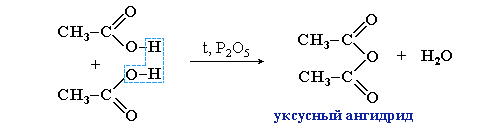
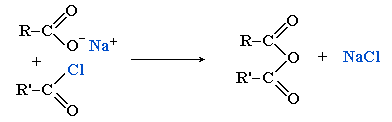
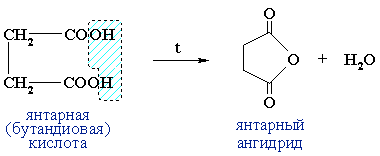
Янтарный ангидрид применяют в производстве лекарственных
средств, инсектицидов, для отвердждения эпоксидных смол.
Малеиновая (цис-бутендиовая) кислота превращается в малеиновый ангидрид уже при ее плавлении: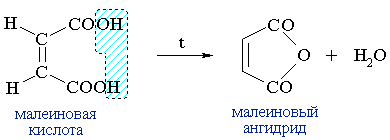
Малеиновый ангидрид служит сырьем для производства полиэфирных смол.(RCO)2O + H2O 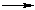 2RCOOH
2RCOOH
Благодаря активности в реакциях ацилирования (введения ацильной группы RCO), ангидриды карбоновых кислот широко применяются в органическом синтезе.

Структурная формула и модель молекулы
(HCO)2O – муравьиный (метановый) ангидрид,
(CH3CO)2O – уксусный (этановый) ангидрид,
(C6H5CO)2O – бензойный ангидрид,
(CH3CH2CH2CH2CH2CO)2O – гексановый ангидрид.
Ангидриды кислот (R–CO)2О образуются при нагревании кислот с водоотнимающими реагентами:
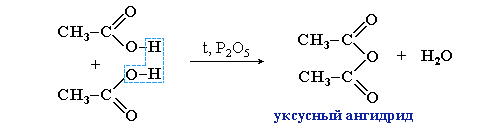
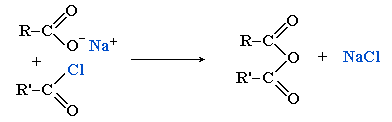
- В биохимических процессах важную роль переносчиков ацильных групп играют смешанные ангидриды карбоновых и фосфорной кислот — ацилфосфаты, например, ацетилфосфат CH3–C(O)–OPO3H2, участвующий в образовании ацетилкофермента А.
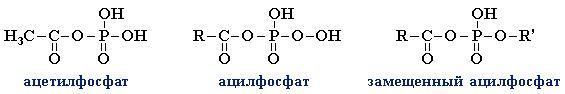
Ацетилнитрат CH3–C(O)ONO2 — смешанный ангидрид азотной и уксусной кислот. Это бесцветная взрывоопасная жидкость, дымящая во влажном воздухе. Его получают из уксусного ангидрида и азотной кислоты или с оксидом азота(V) N2O5:
 CH3–C(O)ONO2 + CH3COOH.
CH3–C(O)ONO2 + CH3COOH.Является относительно мягким нитрующим агентом и применяется для нитрования реакционноспособных ароматических или гетероциклических соединений.
Дикарбоновые кислоты при нагревании образуют циклические ангидриды в результате внутримолекулярной дегидратации:

Янтарный ангидрид применяют в производстве лекарственных
средств, инсектицидов, для отвердждения эпоксидных смол.
Малеиновая (цис-бутендиовая) кислота превращается в малеиновый ангидрид уже при ее плавлении:

Малеиновый ангидрид служит сырьем для производства полиэфирных смол.
Ангидриды проявляют высокую реакционную способность в реакциях с нуклеофильными реагентами, содержащими подвижный атом водорода (вода, спирты, аммиак, амины и т.п.). Ангидриды легко гидролизуются, часто самопроизвольно, с образованием исходной кислоты.
 2RCOOH
2RCOOHГалогенангидриды (ацилгалогениды) R-CO-Hal — функциональные производные карбоновых кислот, в которых гидроксильная группа замещена на галоген (Hal).
Представитель галогенангидридов (ацилгалогенидов) – хлорангидрид уксусной кислоты или ацетилхлорид:

Структурная формула и модель молекулы
1. Названия галогенангидридов составляют из тривиального названия группы ацил R-CO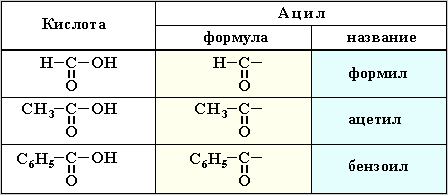 и суффикса галогенид (фторид, хлорид, бромид и т.п.):
и суффикса галогенид (фторид, хлорид, бромид и т.п.):
H–COCl – формилхлорид,
CH3COBr – ацетилбромид,
C6H5COF – бензоилфторид.
2. Часто используются систематические названия ацилов,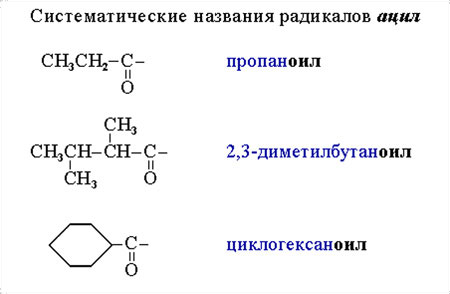 состоящие из названия соответствующего углеводорода и суффикса оил:
состоящие из названия соответствующего углеводорода и суффикса оил:
C3H7COCl – бутаноилхлорид,
(CH3)2CHCOBr – 2-метилпропаноилбромид.
RCOOH + PCl3  RCOCl + H3PO3
RCOCl + H3PO3
а также тионилхлорида (хлорангидрида сернистой кислоты) SOCl2:
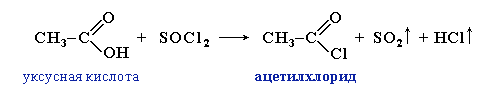
фторангидриды > хлорангидриды > бромангидриды > йодангидриды.
Практическое значение в основном имеют хлорангидриды, в меньшей степени – бромангидриды.
При взаимодействии галогенангидридов с водой, спиртами, аммиаком и аминами образуются соответствующие продукты ацилирования: карбоновые кислоты, сложные эфиры, амиды первичные (незамещённые) и амиды N-замещённые (вторичные и третичные).
Например, очень легко идёт реакция хлорангидрида с водой (гидролиз) с образованием исходной кислоты:RCOCl + H2O  RCOOH + HCl
RCOOH + HCl
Реакция идёт самопроизвольно, в большинстве случаев со скоростью,
зависящей от растворимости хлорангидрида в водной среде.

Структурная формула и модель молекулы
1. Названия галогенангидридов составляют из тривиального названия группы ацил R-CO
 и суффикса галогенид (фторид, хлорид, бромид и т.п.):
и суффикса галогенид (фторид, хлорид, бромид и т.п.):H–COCl – формилхлорид,
CH3COBr – ацетилбромид,
C6H5COF – бензоилфторид.
2. Часто используются систематические названия ацилов,
 состоящие из названия соответствующего углеводорода и суффикса оил:
состоящие из названия соответствующего углеводорода и суффикса оил:C3H7COCl – бутаноилхлорид,
(CH3)2CHCOBr – 2-метилпропаноилбромид.
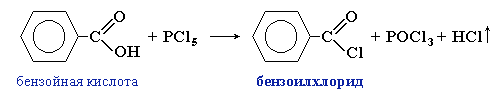
Хлорангидриды получают из карбоновых кислот действием хлоридов фосфора(III) и фосфора(V):
 RCOCl + H3PO3
RCOCl + H3PO3
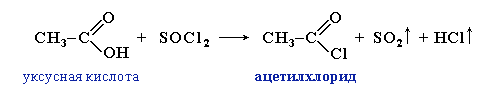
При взаимодействии галогенангидридов с водой, спиртами, аммиаком и аминами образуются соответствующие продукты ацилирования: карбоновые кислоты, сложные эфиры, амиды первичные (незамещённые) и амиды N-замещённые (вторичные и третичные).
Например, очень легко идёт реакция хлорангидрида с водой (гидролиз) с образованием исходной кислоты:
 RCOOH + HCl
RCOOH + HCl
Реакция идёт самопроизвольно, в большинстве случаев со скоростью,
зависящей от растворимости хлорангидрида в водной среде.








