Кислотные свойства гидроксисоединений
Одноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др), образуя соли –
алкоголяты (алкоксиды):
2R–OH + 2Na 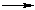 2RO–Na+ + H2↑
2RO–Na+ + H2↑
2C2H5OH + 2K 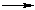 2C2H5O–K+ + H2↑
2C2H5O–K+ + H2↑
 Видеоопыт
Видеоопыт "Взаимодействие спиртов с металлическим натрием".
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла:
C2H5OK + H2O 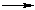 C2H5OH + KOH
C2H5OH + KOH
Следовательно, спирты – более слабые кислоты, чем вода. Это объясняется тем, что алкильный радикал, проявляя +
I-эффект, повышает электронную плотность на атоме кислорода и уменьшает полярность связи О–Н. Поэтому при взаимодействии спиртов со щелочами алкоголяты практически не образуются:
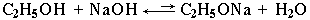
Равновесие этой реакции сдвинуто влево,
так как соли спиртов в воде гидролизуются.
Можно добавить, что кислотность спиртов проявляется в способности вытеснять углеводороды, которые относятся к еще более слабым кислотам, из их солей (например, из реактивов Гриньяра RMgHal):
R–OH + R'MgBr 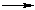 R'H + Mg(OR)Br
R'H + Mg(OR)Br
Кислотность одноатомных спиртов убывает в ряду:
CH3OH > первичный > вторичный > третичный
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (–I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов:
2HO–CH2CH2–OH + 4Na 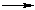 2NaO–СH2CH2–ONa + 2H2↑
2NaO–СH2CH2–ONa + 2H2↑
HO–CH2CH2–OH + NaOH 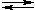 HO–CH2CH2–ONa + H2O
HO–CH2CH2–ONa + H2O
Реакция многоатомных спиртов с NaOH идёт по первой ступени.
 Видеоопыт
Видеоопыт "Взаимодействие глицерина с металлическим натрием".
Такие спирты, в отличие от одноатомных, взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи и образуют внутрикомплексные соли меди(II), имеющие глубокую синюю окраску (качественная реакция):
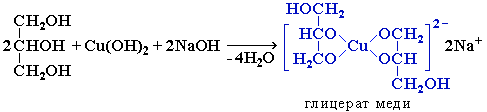
Следует иметь в виду, что гидроксид меди (II) в отсутствие щелочи и при нагревании действует как окислитель. Поэтому несоблюдение условий проведения качественной реакции может привести к ошибочному результату.
 Видеоопыт
Видеоопыт "Взаимодействие многоатомных спиртов с гидроксидом меди (II)".
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам и в эту реакцию не вступают.
Фенолы являются более сильными кислотами, чем спирты и вода, поскольку связь О–Н при бензольном кольце, как уже отмечалось ранее, обладает повышенной полярностью, а соответствующие арилоксид-анионы ArO– – большей устойчивостью.
Раствор фенола в воде проявляет слабокислую реакцию за счёт частичной диссоциации:
C6H5OH 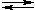 C6H5O– + H+
C6H5O– + H+
Отсюда произошло его название "карболовая кислота" (0,5-5% растворы применяются для дезинфекции).
Фенолы реагируют не только с металлическим натрием, но и с гидроксидами щелочных и щелочноземельных металлов, образуя соли –
феноляты:
C6H5OH + NaOH 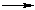 C6H5ONa + H2O
C6H5ONa + H2O
Однако фенол слабее органических и неорганических кислот. По силе он уступает даже угольной кислоте и не взаимодействует с раствором
NaHCO3.На нерастворимости фенолов в растворе гидрокарбоната натрия основано их отделение от карбоновых кислот RCOOH, образующих растворимые соли.
Напротив, его соли разлагаются угольной кислотой:
C6H5ONa + H2CO3 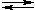 C6H5OH + NaHCO3
C6H5OH + NaHCO3
Кислотность фенола резко возрастает при введении в бензольное кольцо электроноакцепторных заместителей (-NO
2, -COOR, -CHO, –C≡N).
Например,
2,4,6-тринитрофенол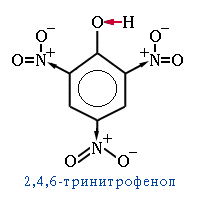
(пикриновая кислота) в 100 раз сильнее фосфорной кислоты. Электронодонорные группы (СН
3 и т.п.), наоборот, ослабляют кислотные свойства фенольных соединений.
 Видеоопыт
Видеоопыт "Взаимодействие фенола с металлическим натрием".
 Видеоопыт
Видеоопыт "Взаимодействие фенола с гидроксидом натрия".
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
 Видеоопыт "Качественная реация на фенол".
Видеоопыт "Качественная реация на фенол".
ГРИНЬЯР Франсуа Огюст Виктор (6.V.1871 - 13.XII.1935)
 Фрацузский химик-органик, член Парижской АН (с 1926). Ученик Ф.А. Барбье. Родился в Шербуре. Окончил Лионский университет (1893). В 1900-1909 работал там же, с 1909 - в университете Нанси (с 1910 профессор). В годы первой мировой войны - в военно-химической лаборатории в Сорбонне. В 1917-1918 читал лекции в Милонском институте (США). В 1919-1935 вновь в Лионском университете, с 1921 одновременно директор Школы химической промышленности в Лионе. Основатель 23-томного издания "Руководство по органической химии". Член ряда Академий наук и научных обществ. Лауреат Нобелевской премии (1912).
Фрацузский химик-органик, член Парижской АН (с 1926). Ученик Ф.А. Барбье. Родился в Шербуре. Окончил Лионский университет (1893). В 1900-1909 работал там же, с 1909 - в университете Нанси (с 1910 профессор). В годы первой мировой войны - в военно-химической лаборатории в Сорбонне. В 1917-1918 читал лекции в Милонском институте (США). В 1919-1935 вновь в Лионском университете, с 1921 одновременно директор Школы химической промышленности в Лионе. Основатель 23-томного издания "Руководство по органической химии". Член ряда Академий наук и научных обществ. Лауреат Нобелевской премии (1912).
Основные исследования посвящены синтезу и изучению органических соединений.
- Осуществил (1900) первые синтезы органических веществ с помощью смешанных магнийорганических соединений, получаемых из алкилгалогенидов и магния в среде эфира.
- Установил (1901), что основным реагентом в таких синтезах является является реактив, состоящий из алкилмагнийгалогенидов, растворенных в эфире (реактив Гриньяра).
- Использовал магнийорганические соединения для синтеза углеводородов, спиртов (1901-1903), кетонов, альдегидов (1906), эфиров, нитрилов, аминов (1920), кислот и др.
- Синтезы на основе смешанных магнийорганических соединений (реакции Гриньяра) нашли широкое применение в химической практике.
- Работы Гриньяра положили начало универсальным методам магнийорганического синтеза, открыв новый этап в развитии препаративной органической химии.
 2RO–Na+ + H2↑
2RO–Na+ + H2↑ 2C2H5O–K+ + H2↑
2C2H5O–K+ + H2↑ Видеоопыт "Взаимодействие спиртов с металлическим натрием".
Видеоопыт "Взаимодействие спиртов с металлическим натрием".
 C2H5OH + KOH
C2H5OH + KOH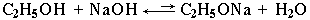
 R'H + Mg(OR)Br
R'H + Mg(OR)Br 2NaO–СH2CH2–ONa + 2H2↑
2NaO–СH2CH2–ONa + 2H2↑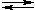 HO–CH2CH2–ONa + H2O
HO–CH2CH2–ONa + H2O Видеоопыт "Взаимодействие глицерина с металлическим натрием".
Видеоопыт "Взаимодействие глицерина с металлическим натрием".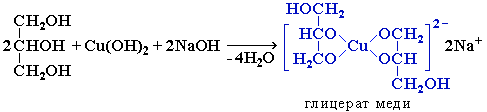
 Видеоопыт "Взаимодействие многоатомных спиртов с гидроксидом меди (II)".
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам и в эту реакцию не вступают.
Видеоопыт "Взаимодействие многоатомных спиртов с гидроксидом меди (II)".
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам и в эту реакцию не вступают.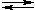 C6H5O– + H+
C6H5O– + H+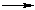 C6H5ONa + H2O
C6H5ONa + H2O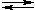 C6H5OH + NaHCO3
C6H5OH + NaHCO3 (пикриновая кислота) в 100 раз сильнее фосфорной кислоты. Электронодонорные группы (СН3 и т.п.), наоборот, ослабляют кислотные свойства фенольных соединений.
(пикриновая кислота) в 100 раз сильнее фосфорной кислоты. Электронодонорные группы (СН3 и т.п.), наоборот, ослабляют кислотные свойства фенольных соединений.
 Видеоопыт "Взаимодействие фенола с металлическим натрием".
Видеоопыт "Взаимодействие фенола с металлическим натрием". Видеоопыт "Взаимодействие фенола с гидроксидом натрия".
Видеоопыт "Взаимодействие фенола с гидроксидом натрия". Видеоопыт "Качественная реация на фенол".
Видеоопыт "Качественная реация на фенол".






 Фрацузский химик-органик, член Парижской АН (с 1926). Ученик Ф.А. Барбье. Родился в Шербуре. Окончил Лионский университет (1893). В 1900-1909 работал там же, с 1909 - в университете Нанси (с 1910 профессор). В годы первой мировой войны - в военно-химической лаборатории в Сорбонне. В 1917-1918 читал лекции в Милонском институте (США). В 1919-1935 вновь в Лионском университете, с 1921 одновременно директор Школы химической промышленности в Лионе. Основатель 23-томного издания "Руководство по органической химии". Член ряда Академий наук и научных обществ. Лауреат Нобелевской премии (1912).
Фрацузский химик-органик, член Парижской АН (с 1926). Ученик Ф.А. Барбье. Родился в Шербуре. Окончил Лионский университет (1893). В 1900-1909 работал там же, с 1909 - в университете Нанси (с 1910 профессор). В годы первой мировой войны - в военно-химической лаборатории в Сорбонне. В 1917-1918 читал лекции в Милонском институте (США). В 1919-1935 вновь в Лионском университете, с 1921 одновременно директор Школы химической промышленности в Лионе. Основатель 23-томного издания "Руководство по органической химии". Член ряда Академий наук и научных обществ. Лауреат Нобелевской премии (1912).
