- Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы С–С–С в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода. Например, отклонение от нормального валентного угла в циклопропане составляет 49°28', что вызывает в цикле большое угловое напряжение α.
 Особенности строения циклопропана
Особенности строения циклопропана
Особенности строения циклопропана.
Предполагается, что связи С–С в циклопропане образованы перекрыванием sp3-АО не по оси (как в σ-связи), а под некоторым углом, так как валентный угол по квантовохимическим расчетам не может быть меньше 90°. Такие связи называют банановыми или
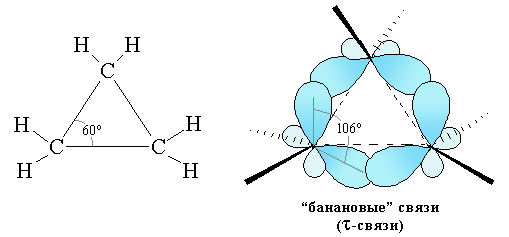
Вследствие менее эффективного перекрывания атомных орбиталей t-связи значительно слабее s-связей.
Зависимость устойчивости циклов от их размера
Устойчивость цикла зависит от числа образующих его атомов и определяется различными видами напряжения.
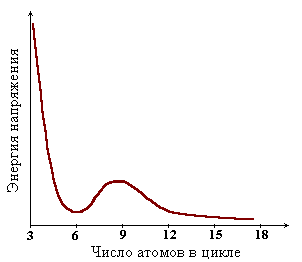
- 3-4 членные (малые) циклы имеют высокое угловое напряжение;
- 5-7 членные (нормальные, ненапряженные) циклы – слабое угловое и торсионное напряжение;
- 8-11 членные (средние) циклы – угловое, торсионное, вандер-ваальсово напряжение;
- 12-ти членные и более (макроциклы) аналогичны ненапряженным алканам с длинными цепями.
Угловое напряжение — увеличение энергии циклической молекулы, вызванное искажением валентных углов в замкнутой цепи. Зависит от числа атомов, образующих цикл.
Торсионное напряжение — увеличение энергии молекулы, связанное с отталкиванием электронных облаков противостоящих связей (например, связей С-Н в заслоненной конформации этана).
Ван-дер-ваальсово напряжение — увеличение энергии, обусловленное силами отталкивания между валентно не связанными большими по объему заместителями.
Неустойчивость малых циклов определяет их стремление к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
- Циклы, содержащие 5 и более атомов углерода, существуют в неплоских формах, лишенных углового напряжения (ненапряженные или нормальные циклы). Типичным их представителем является наиболее устойчивый 6-членный цикл (циклогексан и его производные). Для ненапряженных циклов характерны реакции замещения, в которых сохраняется циклическая структура.
Реакции малых циклов (С3, С4)
1. Гидрирование (присоединение водорода):
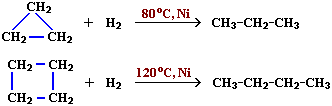
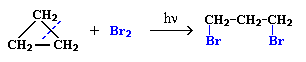
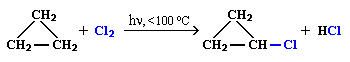
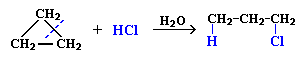
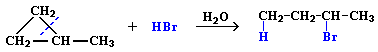
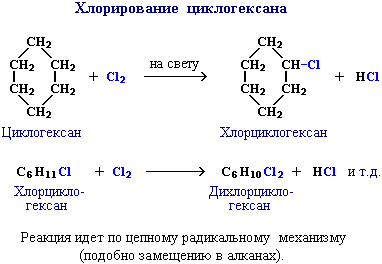
1. Галогенирование (замещение водорода на галоген)
2. Дегидрирование (отщепление водорода)
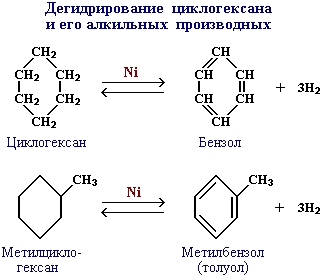
Реакция с другими циклоалканами (C5, C7 и т.д.) приводит к образованию циклоалкенов.
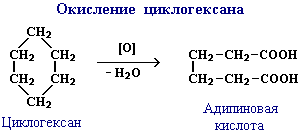
Окисление циклоалканов
При обычной температуре циклоалканы устойчивы к действию окислителей (например, не обесцвечивают раствор KMnO4 – в этом их отличие от изомерных алкенов). При контакте с открытым пламенем горят, то есть окисляются полностью, выделяя большое количество тепла:
 2nCO2 + 2nH2O + Q
2nCO2 + 2nH2O + Q с кислородом или воздухом взрывоопасные смеси.
Практическое значение имеют реакции направленного окисления циклогексана. В зависимости от условий при этом получают ряд ценных продуктов. При окислении без разрыва связей С–С получают циклические продукты (спирт и кетон):
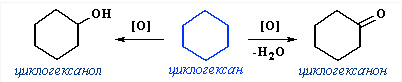
капролактама и синтетического волокна капрон.