Свойства сопряжённых алкадиенов
Наибольшее практическое значение среди сопряжённых диенов имеют:
дивинил или бутадиен-1,3 CH2=CH–CH=CH2 (легко сжижающийся газ, Tкип –4,5 °C),
изопрен или 2-метилбутадиен-1,3 CH2=C(CH3)–CH=CH2 (летучая жидкость, Tкип 34 °С).
По химическим свойствам диеновые углеводороды подобны алкенам – дают те же качественные реакции (обесцвечивают растворы брома или перманганата калия), легко окисляются и вступают в реакции присоединения по электрофильному и радикальному механизмам.
Однако сопряжённые диены отличаются от алкенов и других диенов характерными особенностями, которые обусловлены делокализацией (рассредоточением) π-электронов (часть I, Делокализованные π-связи).
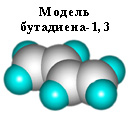
Молекула бутадиена-1,3
СН2=СН–СН=СН2 содержит четыре атома углерода в sp
2-гибридизованном состоянии и имеет плоское строение (все атомы углерода и водорода лежат в одной плоскости).
π-Электроны двойных связей образуют единое π-электронное облако (сопряжённую систему) и делокализованы между всеми атомами углерода.
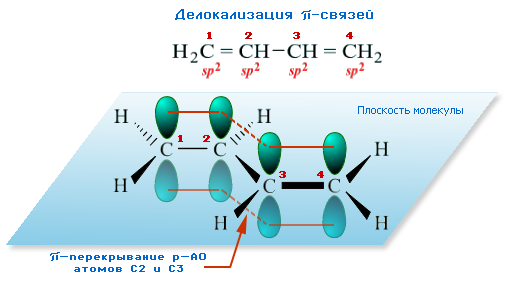
Порядок связей (число общих электронных пар) между атомами углерода имеет
промежуточное значениеПо квантовохимическим расчётам в молекуле бутадиена-1,3 порядок концевых связей C(1)-C(2) и С(3)-С(4) равен 1,894, порядок центральной связи С(2)-С(3) равен 1,447.
между 1 и 2 , то есть нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными связями.

Аналогично построены молекулы изопрена CH2=C(CH3)-CH=CH2:
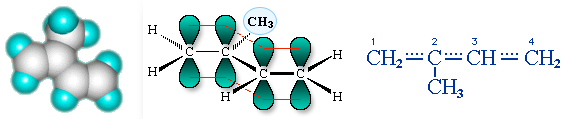
Образование единого π-электронного облака, охватывающего 4 атома углерода,
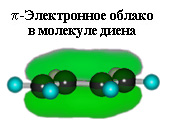 приводит к возможности присоединения реагента по концам этой системы, то есть к атомам С(1) и С(4). Поэтому дивинил и изопрен наряду с присоединением реагента по одной из концевых двойных связей (1,2- или 3,4-) вступают в реакции 1,4-присоединения.
Соотношение продуктов 1,2- (3,4-) и 1,4-присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения). В избытке реагента присоединение происходит по обеим кратным связям.
приводит к возможности присоединения реагента по концам этой системы, то есть к атомам С(1) и С(4). Поэтому дивинил и изопрен наряду с присоединением реагента по одной из концевых двойных связей (1,2- или 3,4-) вступают в реакции 1,4-присоединения.
Соотношение продуктов 1,2- (3,4-) и 1,4-присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения). В избытке реагента присоединение происходит по обеим кратным связям.
Делокализованные π-связи отличаются от локализованных (изолированных) π-связей более высокой
поляризуемостьюПоляризуемость связи – способность к смещению электронов и приобретению дипольного момента под влиянием внешнего электрического поля, в том числе при действии полярного реагента. Поляризуемость сопряжённых π-связей зависит от числа делокализованных электронов. Чем меньше система сопряжения и число её электронов, тем ниже поляризуемость.. Это расширяет реакционную способность сопряженных диенов: кроме реакций
радикального и электрофильного присоединения, свойственных алкенам, возможно также
нуклеофильное присоединение (
часть I. Нуклеофильные реакции).
Например, бутадиен и изопрен вступают в реакцию
анионной полимеризации под действием щелочных металлов или металлоорганических соединений, в ходе которой образуются
карбанионыКарбанион – частица с отрицательным зарядом на атоме углерода, имеющем неподелённую электронную пару. Например: 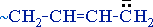
(сильные нуклеофилы), способные присоединять молекулы диена.




 приводит к возможности присоединения реагента по концам этой системы, то есть к атомам С(1) и С(4). Поэтому дивинил и изопрен наряду с присоединением реагента по одной из концевых двойных связей (1,2- или 3,4-) вступают в реакции 1,4-присоединения.
Соотношение продуктов 1,2- (3,4-) и 1,4-присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения). В избытке реагента присоединение происходит по обеим кратным связям.
приводит к возможности присоединения реагента по концам этой системы, то есть к атомам С(1) и С(4). Поэтому дивинил и изопрен наряду с присоединением реагента по одной из концевых двойных связей (1,2- или 3,4-) вступают в реакции 1,4-присоединения.
Соотношение продуктов 1,2- (3,4-) и 1,4-присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения). В избытке реагента присоединение происходит по обеим кратным связям.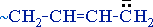 (сильные нуклеофилы), способные присоединять молекулы диена.
(сильные нуклеофилы), способные присоединять молекулы диена.








