Свойства аренов
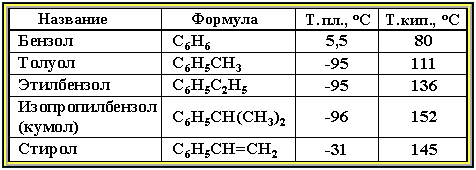
Физические свойства. Бензол и его ближайшие гомологи – бесцветные жидкие вещества (см. табл.), нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (поражает почки, печень, костный мозг, кровь).
 Видеоопыт "Изучение физических свойств бензола".
Видеоопыт "Изучение физических свойств бензола".Химические свойства. Несмотря на ненасыщенность углеродного скелета, арены резко отличаются по химическим свойствам от непредельных углеводородов. Вследствие повышенной устойчивости (ароматичности) бензольного кольца арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности.
 Видеоопыт "Отношение бензола к бромной воде и раствору KMnO4".
Для аренов более характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атома водорода, связанного с циклом.
Видеоопыт "Отношение бензола к бромной воде и раствору KMnO4".
Для аренов более характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атома водорода, связанного с циклом.Повышенная электронная плотность (6 π-электронное облако) бензольного кольца определяет возможность его атаки электронодефицитным (электрофильным)Электрофильный реагент или электрофил — это частица (катион или молекула), имеющая свободную орбиталь на внешнем электронном уровне и способная к образованию связи по донорно-акцепторному механизму. реагентом. Поэтому для ароматических соединений типичны реакции замещения в бензольном ядре, идущие по электрофильному механизму. При этом электрофильная группа вытесняет водород в виде H+, гетеролитически разрывая связь
Другие реакции, в которых участвуют делокализованные углерод-углеродные связи бензольного кольца и нарушается его ароматичность, идут значительно труднее (в жестких условиях).Повышенная температура, УФ-облучение, давление. Часто эти реакции идут по радикальному механизму.








