Реакции присоединения к алкенам
Алкены вступают в реакции присоединения с различными реагентами: 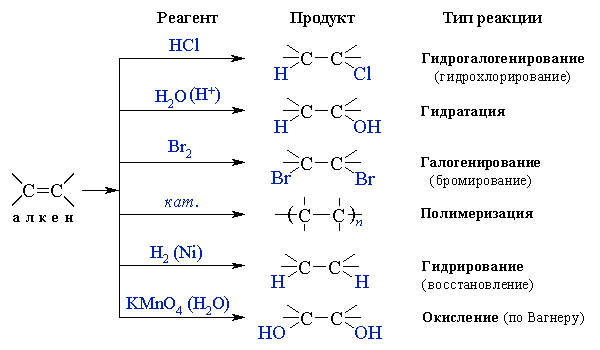
По какому механизму идут эти реакции?
Известно, что механизм реакции зависит от способа разрыва ковалентной связи в реагирующей молекуле (см. часть I, Классификация реакций...) и определяется природой связи и характером реагента.
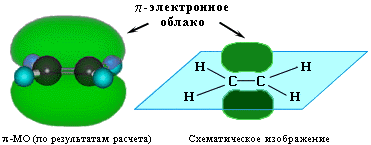
- В молекулах алкенов имеется область повышенной электронной плотности за счет электронов π-связи (облако π-электронов над и под
плоскостью молекулы):
- С другой стороны, углерод-углеродная π-связь в алкенах, являясь неполярной, может разрываться гомолитически под действием свободно-радикальныхСвободный радикал – частица с неспаренным электроном: •Cl, •R и т.п. реагентов, и тогда реакция будет идти по радикальному механизму.
Механизм радикального присоединения обозначается символом АdR (R – radical - радикал). - Механизм присоединения к алкенам зависит от природы реагента и условий проведения реакции.
Механизм электрофильного присоединения обозначается символом АdЕ
(по первым буквам английских терминов: Ad – addition [присоединение], Е - electrophile [электрофил]).








